Cила взаимодействия равна 0,225 Н
Объяснение:
Задание:
Два небольших одинаковых металлических шарика, которые находились в воздухе и имели заряды +5 мкКл и - 10 мкКл, привели в контакт и раздвинули на расстоянии 50см друг от друга. С какими силами они взаимодействуют?
q₁ = +5 мкКл = 5·10⁻⁶ Кл
q₁ = -10 мкКл = -10·10⁻⁶ Кл
k = 9·10⁹ Н·м²/Кл² - электрическая постоянная
r = 50 см = 0,5 м
F₁ - ? - сила электрического взаимодействия
После контакта и последующего разъединения шариков их заряды сравнялись и стали равными
q - 0.5 (q₁ + q₂) = 0.5 · (5·10⁻⁶ - 10·10⁻⁶) = - 2.5·10⁻⁶ (Кл)
Кулонова сила взаимодействия шариков равна
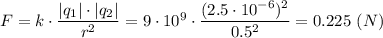
Ясно, что в положении равновесия шар находится на некоторой высоте hh над дном водоема, а цепь частично лежит на дне, частично висит в воде между дном и шаром, причем висящий участок цепи вертикален (рис.). Данные задачи таковы, что можно заранее утверждать, что шар целиком находится под водой (в противном случае почти вся цепь оказалась бы висящей, что невозможно ввиду большой плотности железа). Высота hh в таком случае получится из условия равенства суммарной силы тяжести шара и висящего участка цепи и действующей на них выталкивающей силы: (M+mh–D/2l)g=ρ(V+mρж+frach−D/2l)g(M+mh–D/2l)g=ρ(V+mρж+frach−D/2l)g. Отсюда h=D2+ρвV−Mm(1−ρв/ρж)l=1,6мh=D2+ρвV−Mm(1−ρв/ρж)l=1,6м Глубина, на которой плавает шар, равна H−h=1,4мH−h=1,4м. Источник: https://earthz.ru/solves/Zadacha-po-fizike-595
электронное строение атомов. на внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. поэтому для всех металлов группы ia характерна степень окисления +1.
этим объясняется сходство свойств всех щелочных металлов.
для них (сверху вниз по группе) характерно:
увеличение радиуса атомов;
уменьшение электроотрицательности;
усиление восстановительных, металлических свойств.
нахождение в природе. из щелочных металлов наиболее широко распространены в природе натрий и калий. но из-за высокой активности они встречаются только в виде соединений.
основными источниками натрия и калия являются:
каменная соль (хлорид натрия nacl),
глауберова соль, или мирабилит — декагидрат сульфата натрия na2so4 · 10h2o,
сильвин — хлорид калия kcl,
сильвинит — двойной хлорид калия-натрия kcl ·nacl и др.
соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
свойства простых веществ. в твёрдом агрегатном состоянии атомы связаны металлической связью. наличие металлической связи обусловливает общие свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
в свободном виде простые вещества, образованные элементами ia группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, высокой мягкостью и пластичностью.
img1.jpg
наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
свойства. щелочные металлы высокой активностью, реагируя с кислородом и другими неметаллами.
поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. они являются сильными восстановителями.
все щелочные металлы активно реагируют с водой, выделяя из неё водород.
пример:
2na+2h2o=2naoh+h2↑.
взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
получение. металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) .
в расплаве хлорида натрия присутствуют ионы:
nacl⇄na++cl−.
при электролизе
на катоде восстанавливаются катионы na+, а на аноде окисляются анионы cl−:
катод (–): 2na++2e=2na,
анод (+): 2cl−−2e=cl2↑.
суммарное уравнение реакции при электролизе расплава хлорида натрия:
2nacl→2na+cl2↑.