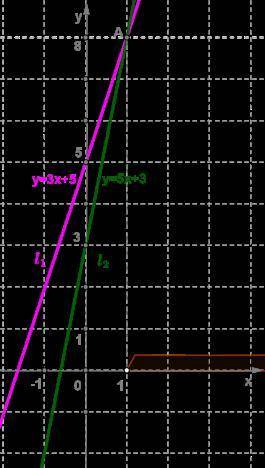
Для решения неравенства 3x+5<5x+3 построим графики линейных функций, расположенных в правой и левой части данного уравнения, т. е. построим графики y=3x+5 и y=5x+3.
Для построения графика каждой линейной функции составим таблицу значений.
Для функции y=3x+5 имеем:
x 0 1
y 5 8
Через полученные точки проведём прямую l1.
Для функции y=5x+3 имеем:
x 0 −1
y 3 −2
Через полученные точки проведём прямую l2.
Прямые y=3x+5 и y=5x+3 пересекаются в точке A(1;8). В этой точке значения функций равны.
Используя построение, делаем вывод: для того чтобы значение первой функции было меньше значения второй функции, необходимо, чтобы первый график был ниже второго, т. е. при x>1.
Можно проверить ответ, полученный при построении, решая неравенство:
3x+5<5x+3;3x−5x<3−5;−2x<−2;x>1.
Объяснение:
ответ: в воду опустили кирпич Cб = 879 Дж/кг *°C.
Объяснение:
mб = 500 г = 0,5 кг.
tб 18 °C.
mв = 400 г = 0,4 кг.
Cв = 4200 Дж/кг *°C.
tв = 100 °C.
t = 83 °C.
Cб - ?
Для определения вещества из которого сделан брусок, необходимо определить удельную теплоёмкость материала из которого сделан брусок Cб.
Qб = Qв.
Qб = Cб *mб *(t - tб).
Qв = Cв *mв *(tв - t).
Cб *mб *(t - tб) = Cв *mв *(tв - t).
Cб = Cв *mв *(tв - t) /mб *(t - tб).
Cб = 4200 Дж/кг *°C *0,4 кг *(100 °C - 83 °C) /0,5 кг *(83 °C - 18 °C) = 879 Дж/кг *°C.
Согласно таблицы удельной теплоёмкости веществ, Cб = 879 Дж/кг *°C соответствует материал кирпич.
ответ: в воду опустили кирпич Cб = 879 Дж/кг *°C.
В хозяйственных магазинах продаётся медный купорос, который используют для борьбы с вредителями сельскохозяйственных растений. Если к голубому водному раствору купороса осторожно, по каплям, добавлять нашатырный спирт (водный раствор аммиака NH3), то выпадает голубой осадок гидроксида меди: CuSO4 + NH3 + Н2O = Cu(OH)2v + (NH4)2SO4 (стрелка, направленная вниз, означает выпадение осадка).
Если осадок немного подогреть (предварительно с него лучше осторожно слить раствор), он почернеет: образовался нерастворимый оксид меди.
Такой же оксид можно получить в результате реакции соединения, если внести в пламя конец медной проволоки и раскалить докрасна.
На меди появится чёрный налёт оксида: 2Cu + O2 = 2СuО.
С медным купоросом легко провести реакцию замещения, если опустить в раствор железный гвоздь (предварительно его желательно очистить от грязи мелкой наждачной бумагой).
Довольно быстро гвоздь покрывается красным налётом чистой меди. А если опыт повторить с одним и тем же раствором (или положить в него много мелких железных предметов), голубой раствор постепенно станет светло-зелёным.
Такой цвет имеет сульфат железа FeSO4; кристаллы этого вещества называются железным купоросом. А теперь проведём красивый опыт с той же медной проволокой и раствором аммиака.
В неширокую металлическую банку нальём на донышко немного крепкого нашатырного спирта (не вдыхать!
). Из медной проволоки скрутим плоскую спираль и, держа проволоку за длинный конец, раскалим спираль на газовой горелке и быстро, чтобы она не успела остыть, внесём её в банку, не касаясь стенок и дна. Произойдёт чудо: вместо того чтобы быстро остыть, проволока останется раскалённой!
Особенно хорошо это заметно в тёмном помещении. Объясняется опыт тем, что в банке находится и воздух, и испарившийся из раствора аммиак.
При окислении аммиака кислородом: 4NH3 + 5O2 = 4NO + 6Н2O выделяется очень много энергии. А так как реакция идёт на поверхности медной проволоки, теплота передаётся меди и не даёт ей остыть.
Этот опыт демонстрирует очень важное явление в химии — катализ. Катализатором называется вещество, которое само в реакции не расходуется, но без которого реакция не идёт (или идёт иначе).
В данном случае катализатором была медь, вернее, её поверхность.