Боровская модель водородоподобного атома (Z — заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро. Переход электрона с орбиты на орбиту сопровождается излучением или поглощением кванта электромагнитной энергии (hν).
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[1]: {\displaystyle m_{e}vr=n\hbar \ } m_{e}vr=n\hbar \ .
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты {\displaystyle R_{n}} R_n и энергии {\displaystyle E_{n}} E_{n} находящегося на этой орбите электрона:
{\displaystyle R_{n}=4\pi {\frac {\varepsilon _{0}}{Ze^{2}}}{\frac {n^{2}\hbar ^{2}}{m_{e}}};\quad E_{n}=-{\frac {1}{8\pi }}{\frac {Ze^{2}}{\varepsilon _{0}}}{\frac {1}{R_{n}}};} {\displaystyle R_{n}=4\pi {\frac {\varepsilon _{0}}{Ze^{2}}}{\frac {n^{2}\hbar ^{2}}{m_{e}}};\quad E_{n}=-{\frac {1}{8\pi }}{\frac {Ze^{2}}{\varepsilon _{0}}}{\frac {1}{R_{n}}};}
Здесь {\displaystyle m_{e}} m_e — масса электрона, {\displaystyle Z} Z — количество протонов в ядре, {\displaystyle \varepsilon _{0}} \varepsilon _{0} — электрическая постоянная, {\displaystyle e} e — заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера в задаче о движении электрона в центральном кулоновском поле.
Радиус первой орбиты в атоме водорода R0=5,2917720859(36)⋅10−11 м[2], ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты {\displaystyle E_{0}=-13.6} E_{0}=-13.6 эВ представляет собой энергию ионизации атома водорода.
1) параллельно силе, недостаточно данных; 2) 1,6 Н или 2,4 Н; 3) 75 Н
Объяснение:
1) 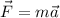 , так что ускорение направлено в ту же сторону, что и сила. Куда направлена скорость, сказать нельзя: сила определяет только то, как изменяется скорость, куда она будет направлена в какой-то момент времени, можно узнать, только зная, куда она была направлена в начальный момент времени
, так что ускорение направлено в ту же сторону, что и сила. Куда направлена скорость, сказать нельзя: сила определяет только то, как изменяется скорость, куда она будет направлена в какой-то момент времени, можно узнать, только зная, куда она была направлена в начальный момент времени
2) Скорее всего, нужно найти среднюю силу, действовавшую на тело. Есть два варианта: скорость в начальный и конечный момент времени направлена в одну сторону или в противоположные. В первом случае модуль изменения скорости 10 м/с - 2 м/с = 8 м/с, среднее ускорение 8 м/с : 2 с = 4 м/с², средняя сила 0,4 кг * 4 м/с² = 1,6 Н. Во втором модуль изменения скорости 10 м/с + 2 м/с = 12 м/с, средняя сила 2,4 Н
3) Ускорение измеряется в м/с², а не м/с!
F = ma = 5 кг * 15 м/с² = 75 Н
V1;P=const V1 \ V2= T1 \ T2 откуда
V2=2V1 Т2= V2*T1 \ V1=2V1*273 \V1=546[K]
T1=273К T2-T1= 546-273=273[K]
T2-T1=? ответ: на 273 К надо нагреть газ