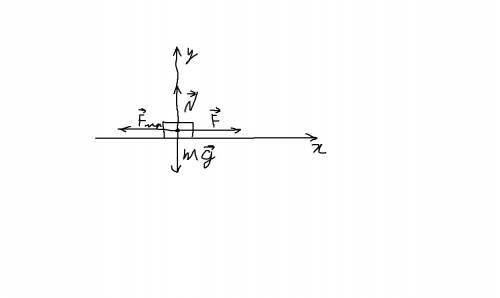
рассмотрим все силы, действующие на брусок.
1)Сила тяги F, направленная по направлению движения бруска.
2)Сила трения F(тр), направленная против движения.
3)Сила тяжести mg, направленная вертикально вниз.
4)Сила реакции опоры, направленная в данном случае вертикально вверх(на самом деле, она всегда направлена перепендикулярно опоре). После решения приложу рисунок, где всё будет показано.
Направим ось x по направлению движения бруска, ось y - вертикально вверх, запишем второй закон Ньютона в векторной форме:
mg + N + F(тр) + F = ma
Мы знаем, что
F(тр) = µN, где µ - коэффициент трения, N - сила реации опоры.
Эту силу найдём из рассмотрения проеций на ось Y закона Ньютона.
N - mg = 0
N = mg
Тогда, F(тр) = µN = µmg = 0.2 * 0.5 * 10 = 1 H
2)В данном случае шкаф не движется потому, что сила трения покоя, возникающая между полом и ножками шкафа, уравновешивается силой, с которой мы действуем на шкаф вдоль поверхности. Сила трения покоя равна по модулю силе, с которой мы действуем на шкаф вдоль поверхности, то есть 50 H.
Понятие валентности формировалось вместе с понятием химической связи, и его содержание неоднократно расширялось и изменялось.
В начале 19 в. Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с определенным числом атомов другого элемента. В середине 19 в., когда были определены точные относительные веса атомов (И. Я. Берцелиус и др.), стало ясно, что число таких связей не превышает определённой величины и зависит от природы атома. Например, атом F может соединяться лишь с одним атомом Н, О — с двумя. Эта связывать или замещать определённое число других атомов и была названа «валентностью» (Э. Франкленд, 1853).
В конце 50-х гг. 19 в. А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А. М. Бутлерова (1861). Молекулы стали изображать с структурных формул, получивших особенно широкое распространение в органической химии.
Периодический закон Д. И. Менделеева (1869) вскрыл зависимость валентности элемента от его положения в периодической системе. Элементы одной группы обладают одинаковой высшей валентностью, в большинстве случаев равной номеру группы. Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная лишь положение элемента в периодической системе, можно было предсказать состав его соединений и впоследствии синтезировать их.
В 1916 Г. Льюис постулировал, что химическая связь осуществляется парой электронов, принадлежащих одновременно обоим взаимодействую-щим атомам. В 1917 В. Коссель выдвинул гипотезу, согласно которой электронная пара связи переходит целиком к одному из атомов с образованием ионной пары катион — анион, удерживающихся в молекуле электростатическими силами. Согласно обеим гипотезам, валентность атома в соединении стала определяться числом его неспаренных электронов, участвующих в связях, а максимальная валентность — полным числом электронов в валентной оболочке атома, то есть номером труппы.
В настоящее время синтезировано большое число разнообразных химических соединений, состав которых не подчиняются простым правилам валентности: координационные соединения, π-комплексы, «нульвалентные» соединения. Поэтому задача нахождения единого определения валентности представляется крайне сложной.
1) Fтрен=MN
N=mg
N=0.5*10=5
F=5*0.2=1
2) Возможно, если сила трения покоя больше, чем действующая сила.
Сила трения покоя всегда равна по величине внешней силе и направлена в противоположную сторону
Значит.
Fтренпокоя=50H