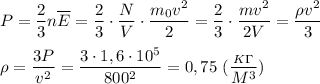
оздух состоит из смеси газов (азота, кислорода и т. д.). Плотность воздуха ρ0 при нормальных условиях (температура t0 = 0 °С и атмосферное давление р0 = 101 325 Па) равна 1,29 кг/м3. Определите среднюю (эффективную) молярную массу М воздуха. Р е ш е н и е. Уравнение состояния идеального газа при нормальных условиях имеет вид Здесь R = 8,31 Дж/(моль • К) и Т0 = 0 °С + 273 °С = 273 К, М — эффективная молярная масса воздуха. Эффективная молярная масса смеси газов — это молярная масса такого воображаемого газа, который в том же объёме и при той же температуре оказывает на стенки сосуда то же давление, что и смесь газов, в данном случае воздух. Отсюда
Виктория, задача решается так:
Дано:
Е = 200 В/м
а = 0,5 м
ε0 = 8,85•10*-12 Ф/м
Найти τ
Е = Q / 4•π•ε0•r*2 где: r - расстояние от заряда до точки наблюдения.
Q = τ•L тогда:
Е = τ•L / 4•π•ε0•r*2
Т. к. заряд Q несёт вся проволока, длину которой будем считать бесконечной, то элемент длины dL будет создавать элементарный заряд dE:
dE = [τ / 4•π•ε0•(a/cosα)*2]•dL (1)
dL = (a/cosα)•dα (2)
Подстаавим (2) в (1):
E = 2•∫[от 0 до π/2] [τ / 4•π•ε0•(a/cosα)*2]•(a/cosα)•dα (3) - в силу симметрии берётся удвоенный интеграл [от 0 до π/2], а не от [от -π/2 до π/2].
Преобразуем (3):
E = ∫[от 0 до π/2] [τ / 2•π•ε0•a]•cosα•dα = [τ / 2•π•ε0•a]• ∫[от 0 до π/2]cosα•dα
E = [τ / 2•π•ε0•a]• sinα [от 0 до π/2] = τ / 2•π•ε0•a
Откуда:
τ = 2•π•ε0•a•E
Вычислим:
τ = 2•3,14•8,85•10*-12 Ф/м • 0.5 м • 200 В/м = 5,6•10*-9 Кл/м - ответ.