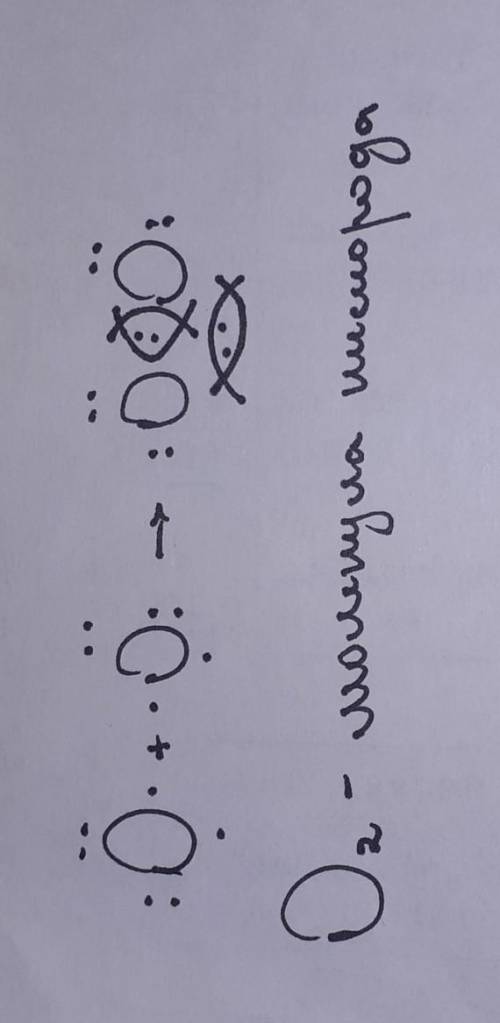
число электронов на последнем уровне - число валетных электронов элемента. эти самые электроны показывают какое их количество входить в соединения с другими электронами.
это число (число валентных электронов) можно вычислить, отняв от 8 номер группы, в которой находится элемент
например, кислород находится в 6ой группе, соответственно, чтобы узнать количество его валентных электронов, нужно от 8 отнять 6, т.е. 2
из этого мы делаем вывод, что 2 его электрона могут соединиться с другими двумя, с образованием электронных пар
таким образом, оба атома обретают устойчивое состояние, дополняя друг друга, образуя молекулу
20.2 г
Объяснение:
Пишем обе реакции
2KNO₃ = 2KNO₂ + O₂ - реакция №1
2AgNO₃ = 2Ag + 2NO₂ + O₂ - реакция №2
Считаем массу кислорода в газовой смеси
m(O₂) = m(смеси) * w(O₂) = 9.4 * 0.5107 = 4.8 г (0.15 моль)
Пусть х моль - количество вещества кислорода в первой реакции, тогда 0.15 - х моль - количество вещества кислорода во второй реакции, а 2(0.15 - х) моль - количество вещества оксида азота. Поэтому
m(O₂) + m(NO₂) = M(O₂) * n(O₂) + M(NO₂) * n(NO₂) = 9.4 г
4.8 + 46 * 2 * (0.15 - x) = 9.4
x = 0.1 моль
Считаем массу нитрата калия
m(KNO₃) = n(KNO₃) * M(KNO₃) = 2n(O₂) * M(KNO₃) = 2 * 0.1 * 101 = 20.2 г
329,4 л
Объяснение:
Запишем формулу аммиака: NH3
Вычислим молярную массу аммиака:
Mr(NH3)=14+3*1=17 г/моль
Вычислим количество вещества NH3:
n(NH3)=m(NH3)/Mr(NH3)=250/17=14,70 моль
Воспользуемся формулой:
n(NH3)=V(NH3)/V(a) (здесь Va - молярный объем газа)
получим:
V(NH3)=V(a)*n(NH3)=14,70*22,4=329,4 л