1)В обоих случаях(т.к обе реации эндотермические) понижение температуры будет смещать равновесие влево( по принципу Ле-Шателье)
2)Увеличение давления:
первая хим. реакция: не повлияет на равновесие( т.к. количества газов равно, т.е коэффициенты при них)
вторая хим. реакция: Равновесие сместится влева( т.е в сторону уменьшения количества молей газов)
3) Увеличение концентрации CO2 в первом случае сместит равновесие влево, во втором вправо. Общее правило: при повышение концентрации какого-либо из исходных веществ, равновесие смещается в сторону продуктов( т.е вправо). И наоборот, если повысить концентрацию одного из продуктов реакции, равновесие сместится в сторону исходных веществ(т.е влево)
Формула любого высшего оксида, составляется на основании его высшей степени окисления, т.е. у любого элемента, будь то магний, будь то азот(исключение - фтор, благородные газы и неамфотерные металлы) есть степень окисления(СО)
Вот магний - элемент второй группы, главной подгруппы, его высшая СО = +2, у кислорода СО всегда -2, значит оксид выглядит: MgO, как составить гидроксид, так же!
В состав гидроксидов входит OH - группа, у нее заряд минус, берем магний, и сравниваем их заряды, у магния +2, значит на один магний с зарядом +2, приходится 2 OH группы, формула:
Mg(OH)2
С неметаллами, в частности с азотом - сложнее. У него есть несколько СО
-3, 0,+1, +2, +3, +4, +5
Конечно высшая СО будет +5
Теперь как разобраться с индексами.
Сначала состроим формулу - скелет:
NO
Теперь расставим СО у элементов: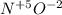 - находим общее кратное, у 5 и 2 это - 10, и теперь надо это кратное, разделить на СО азота и СО кислорода, получим - 2 и 5, строим формулу:
- находим общее кратное, у 5 и 2 это - 10, и теперь надо это кратное, разделить на СО азота и СО кислорода, получим - 2 и 5, строим формулу:
N2O5
Высший гидроксид оксидов неметаллов - кислота, у N2O5 - HNO3
1)
Дано
m(Li2O) = 100 г
n(Li2O) -?
Решение
n = m/M
M(Li2O) = 2*7г/моль + 16 г/моль = 30 г/моль
n = 100г / 30г/моль ≈ 3.3 моль
2) не особо понятно задан вопрос, вроде имеется ввиду про ZnO
Дано
n(ZnO) = 3 моль
m -?
Решение
M(ZnO) = 65 г/моль + 16 г/моль = 81 г/моль
n = m/M
m = n×M = 3 моль * 81 г/моль = 243 г