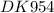Дано:
m(р-ра Na2SO4 ) – 14,4 гр
ω (Na2SO4 ) = 20%
Найти:
m (осадка)-?
n(Ва(NO3)2) - ?
ω = m(в-ва) х 100% / m( р-ра)
m(в-ва) = ω х m( р-ра) / 100%
m (Na2SO4)= 20% x 14,4гр / 100% = 2,88гр
2,88гр Хмоль Хгр
Na2SO4 + Ва(NO3)2 = BaSO4↓ + 2NaNO3
m=142гр n=1 моль m=233гр
m=M x n
m (Na2SO4)=142гр/моль х 1моль = 142гр
m (BaSO4↓)=233гр/моль х 1моль = 233гр
Найдем массу осадка – сульфата бария
Составим пропорцию по уравнению:
2,88гр/142гр = Хгр/233гр
m (BaSO4↓)=2,88гр х 233гр / 142гр = 4,7гр
Найдем количество вещества нитрата бария:
Составим пропорцию по уравнению:
2,88гр/142гр = Хмоль/1моль
n(Ва(NO3)2) = 2,88гр х 1 моль / 142гр = 0,02моль
Дано:
ω(NaOH) = 60%
m(Si) = 16 гр
Найти:
m(р-ра NaOH) - ?
1) Для начала мы запишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться:
Si + 2NaOH + H₂O → Na₂SiO₃ + 2H₂↑
2) Далее находим количества вещества у кремния, потом у гидроксида натрия по уравнению реакций:
M(Si) = 28 гр/моль
n(Si) = m(Si)/M(Si) = 16 гр / 28 гр/моль = 0,5 моль ⇒ n(NaOH) = 2n(Si) = 2×0,5 моль = 1 моль
3) Теперь находим массу у гидроксида натрия:
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
m(NaOH) = n(NaOH)×M(NaOH) = 1 моль × 40 гр/моль = 40 гр
4) Теперь находим массу 60% раствора у гидроксида натрия:
m(р-ра NaOH) = (m(NaOH)×100%)/ω(NaOH) = (40 гр × 100%)/60% ≈ 40 гр × 1,667 ≈ 66,68 гр ≈ 66,7 гр
ответ: m(р-ра NaOH) = 66,7 гр
Решено от :