Объяснение:
при разложении 3,12 г двухосновной кислоты в состав которой входит элемент 4 группы периодической системы, получили соответствующий твёрдый Андигидрид который сплавили с гидроксидом калия с образованием 6,16г средней соли. Какая кислота было взято?
По всей вероятности речь идет о нерастворимой метакремниевой кислоте H2SiO3 Молярная масса этой кислоты 78 г/моль.
Тогда 3,12 г этой кислоты соответствует 0,04 моль.
При нагревании H2SiO3 > SiO2↓ + H2O↑
SiO2 + 2KOH = K2SIO3
Метасиликат калия имеют молярную массу 154 г/моль и 0,04 моль этой соли имеют массу 6,16 г
ответ: в оксиде лития массовая доля оксигена наибольшая. Так как она будет равна 53%
Объяснение:
Для начала нужно вычислить Mr элементов. Формула относительной молекулярной массы :
Mr(элемента) =Ar(Эл)+Ar(Эл) +......
Далее зная Mr мы вычисляет массовую долю каждого элемента (формула на картинке)
как видим в оксиде лития w=53%, натрия w=25% а у оксида калия массовая доля равно 17%. Большая у Li2O=53%
Надеюсь я правильно поняла что требовалось в условиях. Сори если есть ошибки в вычисления. Дано написано не аккуратно потому что просто для галочки, а так надо нормально написать
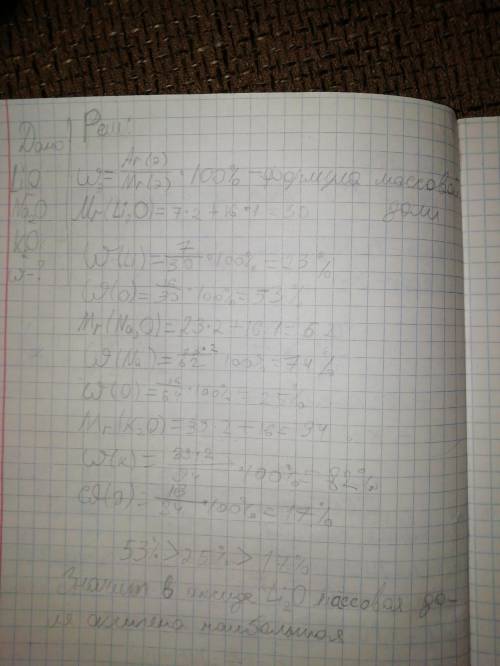
Основание — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (−OH).
а) LiOH, KOH, RbOH
б) Fe(OH)2, Sr(OH)2, Cr(OH)2