СН3 - СН2-СН2-СНО бутаналь
Объяснение:
88. При нагревании альдегида со свежеприготовленным раствором гидроксида меди(II) образовался осадок, масса которого в 2 раза превышала массу исходного альдегида. Установить формулу альдегида
R - C = O + 2Cu(OH)2 > R - C = O + Cu2O ↓ + 2H2O
I I
H OH
M(Cu2O) = 143 г/моль M 1/2(Cu2O) = 71,5 г/моль
Так как М(R-CHO) эквивалентна 1/2 М(Cu2O), то и m(R-CHO) эквивалентна 1/2 m(Cu2O)
Молярная масса бутаналя СН3-СН2-СН2-СНО равна 72 г/моль
72 г/моль 143,1 г/моль
СН3(СН2)2СНО + 2Сu(OH)2 > СН3(СН2)2СOОH + Cu2O + 2H2O
Масса 1 моль бутуналя 72 г масса 1 моль монооксида димеди
143,1 г
Вообще, в этой реакции должен выйти хромат-ион, т.к. среда щелочная и Cr +3 переходит в CrO4 -2, и раствор меняет свой цвет: ион Cr +3 придает р-ру зеленый цвет, а когда он превращается в хромат-ион то цвет меняется на желтый. Теперь, чтобы получить дихромат-ион нужно просто добавить серной кислоты, и пойдет реакция:
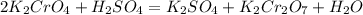 , где хромат-ион превращается в дихромат, поэтому можно писать реакцию окисления оксида хрома(III) с образованием дихромат-иона. А чтобы из дихромата снова хромат - это невозможно сделать одной реакцией. Надо: 1) в дихромата калия добавить восстановитель в кислой среде, здесь мы получим сульфат хрома(III):
, где хромат-ион превращается в дихромат, поэтому можно писать реакцию окисления оксида хрома(III) с образованием дихромат-иона. А чтобы из дихромата снова хромат - это невозможно сделать одной реакцией. Надо: 1) в дихромата калия добавить восстановитель в кислой среде, здесь мы получим сульфат хрома(III):
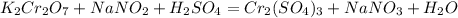 , 2) далее твоя реакция, только вместо оксида используешь сульфат хрома(III), полученный в реакции, и выйдет у тебя хромат калия.
, 2) далее твоя реакция, только вместо оксида используешь сульфат хрома(III), полученный в реакции, и выйдет у тебя хромат калия.
Объяснение:
Дано:
n(H₂O)=10моль
Q₁-?
1. Разложение воды на простые вещества реакция эндотермическая, тоесть идет с поглощением энергии.
2. Термохимическое уравнение реакции разложения воды на простые вещества:
2H₂O = 2H₂ (г) + O₂(г) - 484 кДж.
2. Составим пропорцию:
по уравнению реакции разлагается количество вещества 2моль и потребуется 484 кДж.
n(H₂O)=2моль потребуется Q= 484 кДж.
n(H₂O)=10моль потребуется Q₁ кДж.
Q₁ кДж.=n(H₂O)×Q÷n(H₂O)
Q₁ кДж.=10моль×484 кДж.÷2моль =2420 кДж.
3. ответ:
для разложения 10моль воды потребуется 2420 кДж. энергии.