«Малые Олимпийские Химические Игры» включанут утв елелумняие -
пы:
1. "Стрельба по химическим элементам". Химические элементы на защите
Родины (сталь, лекарство, взрывчатые вещества) (максимальное количести
- 20).
2. »Химическая эстафета". Среда раствора, индикаторы (максимальное ко-
личество - 20).
3. »Тяжелая атлетика". Научные подвиги советских ученых во имя победа
(взрывчатые вещества, лекарственные препараты) (максимальное количество
- 20).
4. »Химический баскетбол". Посуда Химическая, название, назначение
(максимальное количество - 20).
5»Интенсивная тренировка". Знание классов неорганических соединений,
металлов и неметаллов, простых сложных веществ, чистых веществ и сме-
сей. Знание формул взрывчатых веществ, используемых во время Великой
Или
Отечественной войны (максимальное количество - 20).
6»Плавание". Решение задач на использование следствия закона Авогадро
(максимальное количество - 20).
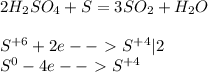
1)Уравнение реакции в общем виде: 4Ме + 3О2 = 2Ме2О3 Отношение количества вещества (Ме) к количеству вещества (Ме2О3) по уравнению реакции =4:2 или 2:1,следовательно (ню) Ме в 2 раза больше, чем Ме2О3. 2)Обозначим М (молярную массу Ме) через Х, тогда М (молярная масса оксида Ме2О3) будет равна 2Х +48 3)количество вещества Ме= м (масса 3г) / м (молярн. масса Х) = 3 / Х г/моль (а) количество вещества оксида = м (5,67г ) / М (2Х +48) =5,67 / 2х+48 г/моль (б) 4)Тогда, т. к. количество вещества Ме в 2 раза больше, следовательно, если значение (а) разделим на (б) = 2 3 / Х : (деление) 5,67 / 2Х +48 =2 3(2Х +48) :( 2Х ) х 5,67=2 6Х +144=11,34Х Х=27(г/моль) т. к. (Х) -молярная масса неизвестного металла, следовательно, это металл Аl(алюминий, степень окисления в оксиде у алюминия (+3),М =27 г моль.