Данная реакция является окислительно-восстановительной, так как реакция протекает с изменением степеней окисления элементов, образующих молекулы реагирующих веществ. Расставим степени окисления элементов в каждом веществе: Mg(0) + H(+)2O(2-) => H(0)2 + Mg(2+)(O(2-)H(+))2. Для удобства и расстановки коэффициентов составим электронный баланс: восстановитель - Mg(0) -2e -> Mg(2+) | 1 - окисление; окислитель - 2H(+) + 2e.
или
Mg(0) + H(1)OH(1) → H(0)2 + Mg(2)O
Это окислительно-восстановительная (редокс) реакция:
2 HI + 2 e- → 2 H0 (восстановление)
Mg0 - 2 e- → MgII (окисление)
Объяснение: Я не знаю что тебе именно нужно так что на в 2х вариантах какое удобнее.
![K_C = \frac{[B]}{[A]^2}](/tpl/images/0480/6039/10359.png)
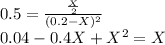
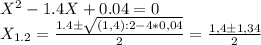
Объяснение:Mr (в-ва)=Mr (CO2)× 1 по усл.= 44×1=44 моль ; v (CO2)=m÷Mr (CO2)=6, 72÷44=0, 15 моль ; m(C)= Mr (C)× v (CO2)=0, 15×12=1, 8 г ; v (H2O)=m (H2O)÷Mr (H2O)=7, 2÷18=0, 4 моль ; v (H)=2v (H2O)=0, 4×2=0, 8 моль ; m (H)=0, 8×Mr (H2)=0, 8 г ; 0, 8+1, 8=2, 6 ; 4, 4-2, 6=1, 8 в недост. ; Соотносим моли, и того алкан с формулой С3Н8
Подробнее - на -