Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная или ковалентная. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
1
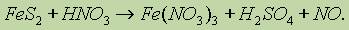
1) Найдем количество вещества хлороводорода
n(HCl) = V(HCl)/Vm = 8,96 л/22,4 л/моль = 0,4 моль
2) Согласно уравнению реакции найдем количество вещества водорода
H₂ + Cl₂ --> 2HCl
Составим пропорцию:
y 0,4
= y = 0,2 моль = n(H₂)
1 2
3) Найдем объем водорода
V(H₂) = n(H₂) × Vm = 0,2 моль × 22,4 л/моль = 4,48 л
4) Согласно уравнению реакции найдем количество вещества хлора
H₂ + Cl₂ --> 2HCl
Составим пропорцию:
y 0,4
= y = 0,2 моль = n(Сl₂)
1 2
5) Найдем объем хлора
V(Cl₂) = n(Cl₂) × Vm = 0,2 моль × 22,4 л/моль = 4,48 л
ответ: V(H₂) = V(Cl₂) = 4,48 л
ответ:3KOH + AlCl3 = Al(OH)3 + 3KCl
3KOH + Fe(NO3)3= Fe(OH)3 + 3KNO3
2KOH + Pb(NO3)2 = Pb(OH)2 + 2KNO3
Ba(OH)2 + Na2SO4= BaSO4 + 2NaOH
3Ba(OH)2 + 2AlCl3= 2Al(OH)3 + 3BaCl2
3Ba(OH)2 + 2Fe(NO3)3= 2Fe(OH)3 + 3Ba(NO3)2
Ba(OH)2 + Pb(NO3)2= Pb(OH)2 + Ba(NO3)2
Fe(OH)3+ AlCl3 = Al(OH)3 + FeCl3
2Fe(OH)3 + 3Pb(NO3)2 = 3Pb(OH)2 + 2Fe(NO3)3
3Ni(OH)2 + 2AlCl3 + 2Al(OH)3 + 3NiCl2
3Ni(OH)2 + 2Fe(NO3)3= 2Fe(OH)3 + 3Ni(NO3)2
Ni(OH)2 + Pb(NO3)2= Pb(OH)2 + Ni(NO3)2
3AgOH + AlCl3 = Al(OH)3 + 3AgCl
2AgOH + Na2SO4 =Ag2SO4 + 2NaOH
3AgOH + Fe(NO3)3= Fe(OH)3 + 3AgNO3
2AgOH + Pb(NO3)2= Pb(OH)2 + 2AgNO3
В каждой реакции выпадают осадки
Объяснение:не знаю с тебя хоть что