Відповідь:
1. Фоточка - 1.png
2. 2Al + 3S → Al₂S₃
Al₂S₃ + 6H₂O → 3H₂S↑ + 2Al(OH)₃
Al(OH)₃ + KOH → K[Al(OH)₄]
K[Al(OH)₄] → KAlO₂↓ + 2H₂O
KAlO₂ + 4HCl → KCl + AlCl₃ + 2H₂O
3. Ag + 2HNO₃ →AgNO₃ + NO₂↑ + H₂O
n(E)=m(E)/Mr(E)
n(Ag)=21.6/108=0.2 моль
m(HNO₃)=600*0.68=408g
n(HNO₃)=408/63=6.5 моль
Значит, азотная кислота в избытке, считаем по серебру:
n(NO₂)= 0.2 моль
2NO₂+ 2NaOH → NaNO₂ + NaNO₃ + H₂O
m(NaOH)=300*0.1=30г
n(NaOH)=30/40=0.75 моль
Значит, NaOH в избытке.
n(NaNO₂)=0.1 моль
m(NaNO₂)=0.1*69=6.9 г
n(NaNO₃)=0.1 моль
m(NaNO₃)=0.1*85=8.5 г
Осталось NaOH: 0.75-0.2=0.55 моль
m(NaOH)=22г
Масса конечного раствора:
300 + m(NO₂)=300+ 0.2*46=309.2 г
Массовые доли:
w(NaOH)= 100*22/309.2=7.1%
w(NaNO₂) 100*6.9/309.2=2.2%
w(NaNO₂)= 100*8.5/309.2=2.7%
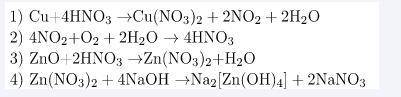
ответ:Дано: Решение m(р-ра)=200гm(р-ра)=200г ω(CuSO4)=18%ω(CuSO4)=18% CuSO4+H2S=H2SO4+CuS↓CuSO4+H2S=H2SO4+CuS↓ m(CuSO4)=ω(CuSO4)⋅m(р-ра)100=18⋅200100=36гm(CuSO4)=ω(CuSO4)⋅m(р-ра)100=18⋅200100=36г n(CuSO4)=m(CuSO4)M(CuSO4)=36160=0.225 мольn(CuSO4)=m(CuSO4)M(CuSO4)=36160=0.225 моль n(CuS)=n(CuSO4)=0.225 мольn(CuS)=n(CuSO4)=0.225 моль m(CuS)=n(CuS)⋅M(CuS)=0.225⋅96=21.6г
Объяснение: