Задача №1
- Уравнение:
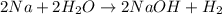
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
Объяснение:
6Na + N₂ = 2Na₃N
2NH₃ + H₂SO₄ = (NH₄)₂SO₄
NH₃ + H₂SO₄ = NH₄HSO₄ (если серная кислота в избытке)
4HNO₃ + Hg = Hg(NO₃)₂ + 2NO₂ + 2H₂O (если кислота концентрированная)
3Hg + 8HNO₃ = 3Hg(NO₃)₂ + 2NO + 4H₂O (если кислота разбавленная)
C + O₂ = CO₂
Na₂CO₃ + Ca(OH)₂ = CaCO₃ + 2NaOH