1. A formic acid, sodium formate solution is made up by dissolving 0.010 more on
acid and 0.023 mole of sodium formate in 100 mL of water? What pH will the buna
solution be at? If 0.01 mole of NaOH is added to this solution what will be the resulting Ph?
(Kof formic acid = 1.8 · 104)
2. Calculate the H" ion concentration and the pH of formic acid solutions with the
following concentrations: 0.10 M, and 0.01 M. (Ka of formic acid = 1.8.10")
3. Find the pH of a solution made by diluting 35 mL of 4.5 M HNO3 to a final volume of
2.25 L.
How to calculate this 3 questions?
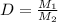
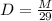
1) При простом сжигании натрия получится оксид натрия, а не пероксид. Пероксид получить сложнее, и необходимо в таком случае написать условия рядом с реакцией
4Na+O2= 2Na2O
Na + O2 = Na2O
оксиды в ионных уравнениях не расписываются, мб имелось в виду это? :
Na(0) - 1e ---> Na(+) |4
О2(0) +4e- ---> 2O(-2) | 1
4Na + O2 = 2Na2O
2) Раскаленное железо сгорает в кислороде с образованием железной окалины:
3Fe +O2 = (t) = Fe3 (+2,+3)O4(-2) или Fe2O3*FeO
(железо передает кислороду 8 электронов)
"Из учебника"
3) 2H2+O2=2H2O
4) S+O2 =t= SO2
Это взаимодействия кислорода с простыми веществами, с металлами и неметаллами)
5) Если при горении сероводорода внести в пламя холодный предмет (охлаждение пламени) то образуется свободная сера
2H2S+O2 = 2H2O + 2S(осадок)
А если обеспечить избыток кислорода,то получится оксид серы (IV):
2H2S +3O2 = 2H2O + 2SO2