Имеются растворы : 1)сульфата цинка,2) хлорида бария, 3)карбоната натрия. если к первому раствору прилить второй, то выпадет 34,95 г осадка. если ко второму раствору прилить третий, то выпадет 39,4 г осадка. какова будет
масса осадка при приливании первого раствора к третьему?
х г 34,95 г
1.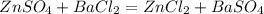
161 г 233 г
Найдем массу сульфата цинка:
при взаимодействии 161 г сульфата цинка выпадает 233 г сульфата бария,а
при -- // -- х г_______________________34,95 г, откуда
х=161*34,95/233=24,15 г
у г 39,4 г
2.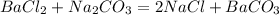
106 г 197 г
Найдем массу карбоната натрия:
при взаимодействии 106 г карбоната натрия выпадает 197 г карбоната цинка,а
при -- // -- у г___________________________39,4 г, откуда
у=106*39,4/197=21,2 г
24,15 г 21,2 г,k г z г
3.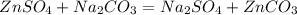
161 г 106 г 125 г
1) определим,какое из исходных веществ прореагирует полностью(без остатка),приняв массу карбоната натрия за k:
для полного взаимодействия 161 г сульфата необходимо 106 г карбоната, а
для -- // -- 24,15 г__________________k г, откда
k=24,15*106/161=15,9 г
2) как видим,что карбоната натрия дано в избытке,значит массу осадка рассчитываем по массе сульфата цинка:
при взаимодействии 161 г сульфата цинка выпадает 125 г карбоната цинка, а
при -- // -- 24,15 г______________________z г, откуда
z=24,15*125/161=18,75 г