

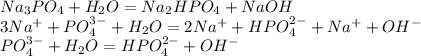
Среда раствора - щелочная из-за образования аниона OH⁻ (pH>7)
HCl - усиливается (так как образуются ионы H⁺, которые реагируют с ионами OH⁻, которых становится меньше и равновесие смещается в сторону продуктов)
H₂O - усиливается (в соответствии с принципом Ле Шателье добавление реагентов смещает реакцию к продуктам)
NaOH - ослабевает (при добавлении NaOH образуются гидроксид ионы, которых становится больше, и равновесие смещается к реагентам)
Na₃PO₄ - ослабевает (при увеличении концентрации соли в растворе степень гидролиза уменьшается)
ZnSO₄ - усиливается (при добавлении в раствор сульфата цинка происходит гидролиз с образованием ионов H⁺, которые реагируют с ионами OH⁻, которых становится меньше и равновесие смещается в сторону продуктов)
Na₂CO₃ - ослабевает (при гидролизе карбоната натрия образуются гидроксид ионы что уменьшает степень гидролиза фосфата натрия)
В общем виде (можно выписать как объяснение):
Чтобы усилить гидролиз Na₃PO₄
Надо добавить сильную кислоту HR или соль слабого основания или сильной кислоты (образуются ионы H⁺ что усиливает гидролиз)
Чтобы ослабить гидролиз Na₃PO₄
Надо добавить сильное основание MeOH или соль сильного основания и слабой кислоты (образуются ионы OH⁻, что ослабляет гидролиз)
1. А
2. Б
3. Г
4. А
5. Б
6. Б
7. А-2
Б-4
В-1
Г-3
8. А-4
Б-3
В-5
Г-1
9. А-4
Б-1
В-2
Г-5
10. 1-В
2-Г
3-Б
4-А
11. ИЗВИНИТЕ НЕ ЗНАЮ
12. Mg + 2HCl -> MgCl2 + H2
m(Mg)= 1,2 г
n(Mg)= 1,2/24=0,05 моль
n(Mg)= n(H2)
V(H2)= 0,05*22,4=1,12 л