6,608 л.
Объяснение:
Дано:
m газов.смеси=12,4 г.
ω (С2Н4) = 22,58 %
ω (С3Н6) =32,26 %
ω (С4Н8) = 45,16 %
Найти:
V (Н2)
1. Записываем уравнения реакций гидрирования углеводородов
С2Н4+Н2→С2Н6
С3Н6+Н2→С3Н8
С4Н8+Н2→С4Н10
2. Чтобы узнать необходимое количество водорода, нужно выяснить количество Н2, участвующего в каждой реакции. Для этого определим количество вещества каждого углеводорода в смеси
ν=m/M
m=ωm(смеси)
m (С2Н4)=0,2258*12,4=2,8 г.
m (C3Н6)=0,3226*12,4=4 г.
m (С4Н8)=0,4516*12,4=5,6 г.
М (С2Н4)=28 г/моль,
М (С3Н6)=42 г/моль,
М (С4Н8)=56 г/моль
ν (С2Н4)=2,8 г./28 г/моль=0,1 моль
ν (С3Н6)=4/42=0,095 моль
ν (С4Н8) 5,6/56=0,1 моль
3. Согласно уравнениям реакций гидрирования, ν(Н2)=ν(СхН2х). Значит общее количество вещества ν (Н2)=0,1+0,095+0,1=0,295 моль
4. Вычисляем объем водорода по формуле V=νVm, где Vm=22,4 л/моль
V=0.295*22.4=6.608 л.
Привет
Начнем с конца.
CuSO4+ 2NaOH = Cu(OH)2 + Na2SO4
m(р-ра) = 48 г
w(р-ра) = 10%
m(CuSO4) = 48×0.1= 4.8 грамм
n(CuSO4) = 4.8/160= 0.03 моль
Так как CuSO4 и NaOH находятся в молярном соотношении 1 к 2, то следует:
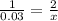
x= 0.06 моль NaOH
При электролизе раствора NaOH выделяется 3 моль газов (2H2 и O2) , но по задаче даётся 134.4 литра
Газы выделяются потому что электролизуется Вода
NaOH не электролизуется
2H2O =(электролиз) 2H2 + O2
При электролизе 2 моль воды, выделятся и улетучивается 3 моль газов, но по задаче даётся 134.4 литра, а это 134.4/22.4 = 6 моль газов
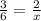
x= 4 моль воды электролизовалось
120×0.1= 12 грамм NaOH
120-12= 108 грамм воды
Так как 72 грамм воды электролизовалось (4×18=72), масса раствора оказалась: 120-72 = 48 грамм
В растворе содержится 12 грамм NaOH
Моль NaOH = 12/40 = 0.3 моль
На осаждение CuSO4 использовали 0.06 моль NaOH
m(NaOH) = 0.06 × 40= 2.4 грамм
Вопрос задачи: Вычислите какую часть (%) раствора использовались для осаждения CuSO4
Масса раствора была 48 грамм - это 100%, 2.4 грамм - X
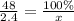
x= 5%
ответ: 5%
Если будут вопросы, отпишитесь в комментариях
Найди бутен, водород составляет 2% от пропена и 2,5% от бутана