Задача 14: 3.76 грамм
Задача 16: 0.8 к 1.8 или 1 к 2.25
Объяснение:
Задание 14:
Mr[Cu(NO3)2] = 188 г/моль
Число атомов: 1Cu + 2N + 6O = 9 атомов всего
N (A) = 9 × 6.02 × 10^23 = 54.18 × 10^23 атомов
N(A) = 1.0835 × 10^23 атомов
m[Cu(NO3)2] = ?
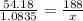
x= 3.76 грамм
m[Cu(NO3)2] = 3.76 грамм
ответ: 3.76 грамм
Задание 16:
Ca3(PO4)2
Mr(соли) = 310 грамм/моль
n(P) = 2 моль атомов фосфора в составе 1 моли соли
m(соли) = 124 грамм
n(соли) = m/Mr = 124/310 = 0.4 моли
n(P) = 2 × 0.4 = 0.8 моль Фосфора в составе соли массой 124 грамма
Al(NO3)3
Mr(соли) = 213 грамм/моль
n(N) = 3 моль атомов азота в составе 1 моли соли
m(соли) = 127.8 грамм
n(соли) = m/Mr = 127.8 / 213 = 0.6 моли
n(N) = 3 × 0.6 = 1.8 моль азота в составе соли массой 127.8 грамм
Соотношение:
n(P) = 0.8
n(N) = 1.8
0.8 к 1.8
или
1 к 2.25
ответ: наиболее трудными егэ являются , направленные на проверку знаний свойств и способов получения веществ. к их числу относится 32 (в прошлом - 38) – «реакции, взаимосвязь органических соединений», данные представляют собой цепочку из пяти стадий превращений органических веществ, и оцениваются в 5 первичных .
при решении 32 необходимо написать пять уравнений реакций, среди которых одно (как минимум) является окислительно-восстановительным. для такой реакции определяются степени окисления элементов и составляется электронный . при написании всех уравнений реакций обязательным условием является расстановка коэффициентов и указание условий во всех реакциях.
обычно в подобных не требуется указывать тонкие технические детали синтеза, точную концентрацию реагентов, конкретных растворителей, методы очистки и выделения и т.д. однако обязательно следует указывать примерные условия проведения реакций.
чаще всего сущность заключается в последовательном решении следующих :
• построение (удлинение или укорачивание) углеродного скелета;
• введение функциональных групп в алифатические и ароматические соединения;
• замещение одной функциональной группы на другую;
• удаление функциональных групп;
•