а) У кислорода: если он стоит один то 0 (это у всех, не только у кислорода)
также есть -2 (чаще всего в соединениях он проявляет такую степень окисления) ,
-1 в 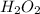 ,
,
+2 в 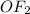 ,
,
так же может быть +4 в аллотропических модификациях кислорода.
б) У серы: -2 в сульфидах, гидросульфидах и сульфидокислотах,
если он стоит один то 0
+4 в тетрагалогенидах например,
+6 в соединениях с наиболее электроотрицательными элементами.
в) У азота: -3 в нитридах
-2 азот проявляет в соединениях перикисного типа,
в соединении под названием гидроксиламин он проявляет степень окисления -1
если он стоит один то 0
также может проявлять степени окисления +1 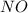 ,
, 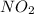 ,
,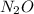
+3 и +5 в фториде, оксидах, оксогалогенидах.
г) Селенах: -2 в 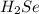 .
. 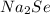
+4 селен проявляет в диоксиде, тетра- и оксогалогенидах
если он стоит один то 0
и в +6 это 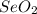 .
. 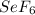
2 - Металлы в основном восстановители ( катионы) имеющие 1-3 электрона на внешнем уровне - чем активней металл тем более восстановительные свойства проявляет
3 - Металлы получаются в
А Рудах и жилах в чистом виде ( Только малоактивные)
B Из соединений при хим реакций ( Обычно - восстанавливаются с водорода)
С Электролизом (Совместно с первым)
4 - Электролиз -один из методов получения металлов ( В Основном из непрочных растворов или расплавов) Он очень , т.к только с его можно получать некоторые вещества ( Без него было бы невозможно полчуать тот-же самый алюминий)