ΔrG=ΔrH-TΔrS, для ΔG0 Т равно 298К
1) ΔН Fe2O3 К = -822,2 кДж/моль, Fe3O4 к = - 1117,1 H2Oг = -241.8
ΔrН = 2*(-1117.1) +(-241.8) - 3*(-822.2) = -476 + 2466.6 = 1790.6
ΔS Fe2O3 К = 60.75 Дж/моль*K, Fe3O4 к = 146.2 H2Oг = 188.74
ΔrS = 2*146.2 +188.74 - 3*60.75 = 481.14-182.25 = 298.89Дж= 0,29889 кДж
ΔrG = 1790.6 -298* 0,29889 = 1701,53
2)
ΔН Fe2O3 К = -822,2 кДж/моль, СО = -110,5 Fe3O4 к = - 1117,1 СО2г = -393,5
ΔrН = 2*(-1117,1) +(-393,5) - [3*(-822.2) +(-110.5)] = -2627.7 + 2577.1 = -50 кДж
ΔS Fe2O3 К = 60.75 Дж/моль*K, СО г = 197,5 Fe3O4 к = 146.2 СО2 г = 213,7
ΔrS = 2* 146,2 + 213,7 - (3*60,75 + 197,5) = 506,1 - 379,75 = 126,35Дж = 0,12635 кДж
ΔrG = -50 - 298*0,12635 = -87,65
3) ΔН Fe2O3 К = -822,2 кДж/моль, СО = -110,5 СО2г = -393,5
ΔrН = 3*(-393,5) - [ -822.2 + 3* (-110.5)] = -1180.5 +1153.7 = -26.8
ΔS Fe2O3 К = 60.75 Дж/моль*K, СО г = 197,5 СО2 г = 213,7
ΔrS = 3*213.7 -(60.75 +3*197.5) = 641.1 -653.25= 12.15Дж = 0,01215
ΔrG = -26,8 - 298 *0,01215 = -23,18
Уравнение реации:
N2 + 3H2 = 2NH3
Константа равновесия, выраженная через молярные концетрации(размерности опущены):
![Kc = \frac{[NH3]^2}{[N2]*[H2]^3}](/tpl/images/0976/4973/2bbb4.png)
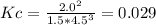
Так как концентрация аммиака в исходной смеси равна нулю, то его равновесная концентрация равна концентрации образовавшегося в ходе реакции аммиака. На образование аммиака были израсходованы некоторые концентрации водорода и азота. Найдём их при стехиометрических соотношений:
c(H2)_расход = 3/2 * 2.0 = 3.0 моль/л.
c(N2)_расход = 1/2 * 2.0 = 1.0 моль/л.
Начальные концентрации исходных веществ равны сумме концентраций израсходованных в результате химической реакции и равновесных веществ:
c(H2)_начальная = 1.5 + 1.0 = 2.5 моль/л.
с(N2)_начальная = 4.5 + 3.0 = 7.5 моль/л.
Відповідь:
CaO+H2O= Ca(OH)2
Пояснення: