решить тест по химии
1.С какими из перечисленных веществ реагирует гидроксид алюминия: соляная кислота (1);
гидроксид калия (2);
вода (3);
сульфат калия (4);
железо (5):
2. Оксидная плёнка при комнатной температуре предохраняет алюминий от взаимодействия с:
а) бромом;
б) соляной кислотой;
в) кислородом;
г) раствором гидроксида натрия.
3.С какими из перечисленных веществ реагирует алюминий:
оксид цинка (1),
раствор гидроксида калия (2);
фосфор (3);
раствор соляной кислоты (4);
раствор нитрата цинка (5);
кальций (6).
А) 1,3,4,5;
б) 1,3,5,6;
в) 1,2,3,4,5;
г) 1,4,5,6.
Напишите уравнения необходимых реакций.
4. Гидроксид алюминия обладает:
А) основными свойствами;
б) кислотными свойствами;
в) амфотерными свойствами;
г) нет правильных ответов.
5.С какими из перечисленных веществ реагирует оксид алюминия: раствор серной кислоты (1);
гидроксид лития (2);
сера (3);
сульфит натрия (4);
медь (5):
А) 1,2,3;
б) 1,2;
в) 1,4,5;
г) 1,2,4.
Напишите уравнения соответствующих реакций.
6.Какие из реакций записаны верно:
А) 2Al+ 6H2O=2Al(OH)3 +3H2
Б) 2Al+ 3H2SO4=Al2(SO4)3+ 3H2
В) 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
Г) Al2O3+ 3CO=2Al+ 3CO2
Д) 2Al+Cr2O3=Al2O3+2Cr
Е) 2Al+3Ca(NO3)2=2Al(NO3)3 +3 Ca
Ж)Al(OH)3+LiOH=Li[Al(OH)4]
З) Na[Al(OH)4]+ 4HCl= AlCl3+ NaCl + 4H2O
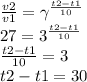
m (FeS) = 8,8г
n (FeS) - ?
M=88
1) m (FeS) = 56+32 = 88г/моль
2) n (FeS) = 8,8/88 = 0,1моль
13) Необходимо понизить давление, чтобы
сместить равновесие в сторону прямой реакции – разложения PCl5.
14) Напомню правило Вант- Гоффа: скорость большинства химических реакций при повышении температуры на каждые 10°с возрастает в 2-4 раза. В конкретной ситуации скорость возрастает в 3 раза:
ответ: температуру надо поднять на 30°.
15) СаСО3 + 2HCl = CaCl2 + H2O + CO2
Х = CO2 - оксид углерода 4 (углекислый газ)
Общая формула оксидов элементов V группы: R2O5