1.
Дано:
m(раствораH₂SO₄)=200г.
ω%=10%
Vm=22,4л./моль
V(H₂)-?
1. Определим массу серной кислоты в 200г. ее 10% раствора:
m(H₂SO₄)=ω%xm(раствораH₂SO₄)÷100%
m(H₂SO₄)=10%×200г.÷100%=20г.
2. Определим молярную массу серной кислоты и ее количество вещества в 20г.:
M(H₂SO₄)=98г./моль
n₁(H₂SO₄)=m(H₂SO₄)÷M(H₂SO₄)=20г.÷98г./моль=0,2моль
3. H₂SO₄+Zn=ZnSO₄+H₂
по уравнению реакции:
n(H₂SO₄)=1моль n(H₂)=1моль
по условию задачи:
n₁(H₂SO₄)=0,2моль n₁(H₂)=0,2моль
4. Определим объем водорода количеством вещества 0,2моль:
V(H₂)= n₁(H₂)xVm
V(H₂)=0,2мольх22,4л./моль=4,48л.
5. ответ: образуется 4,48л. водорода при взаимодействии цинка с 200г 10% раствора серной кислоты.
2.
Дано:
m(раствораCuSO₄)=160кг.
ω%=10%
m(Fe)=12кг.
m(Cu)-?
1. Определим массу сульфата меди в 160кг. ее 10% раствора:
m(СuSO₄)=ω%xm(раствораCuSO₄)÷100%
m(CuSO₄)=10%×160г.÷100%=16кг.
2. Определим молярную массу сульфата меди и ее количество вещества в 16кг.:
M(CuSO₄)=160кг./кмоль
n₁(CuSO₄)=m(CuSO₄)÷M(CuSO₄)=16кг.÷160кг./кмоль=0,1кмоль
3. Оапределим молярную массу железных опилок и их количество вещества в 12кг.:
M(Fe)=56кг./кмоль
n₁(Fe)=m(Fe)÷M(Fe)=12кг÷56кг./кмоль=0,2кмоль
4. CuSO₄+Fe=FeSO₄+Cu
по уравнению реакции:
n(CuSO₄)=1кмоль n(Fe)=1кмоль
по условию задачи:
n₁(CuSO₄)=0,1кмоль n₁(Fe)=0,2кмоль
Железные опилки даны в избытке. Решаем задачу используя количество вещества сульфата меди:
по уравнению реакции:
n(CuSO₄)=1кмоль n(Cu)=1кмоль
по условию задачи:
n₁(CuSO₄)=0,1кмоль n₁(Cu)=0,1кмоль
5. Определим молярную массу меди и ее массу количеством вещества 0,1кмоль:
M(Cu)=64кг./кмоль
m(Cu)=n₁(Cu)xM(Cu)
m(Cu)=0,1кмольх64кг./кмоль=6,4кг.
7. ответ: при взаимодействии 60 кг 10%раствора сульфата меди с 12 кг. железных опилок выделилось 6,4кг. меди.
Ca(OH)2+K2CO3=>CaCO3 + 2KOH
Дано:
m(K2CO3)=64г.
+
m(Ca(OH)2)=17.4г
===================
m(CaCO3)-? P.S (CaCO3 яв-ся осадком белого цвета)
===================
По формуле n = m : M, найдем сначала кол-во вещ-ва Ca(OH)2, затем K2CO3:
1) n(Ca(OH)2) = 17.4г : 74 г/моль = 0.235 моль
2) n(K2CO3) = 64 г : 138 г/моль = 0.46 ≈ 0.5 моль
Это задача на избыток и недостаток. Мы должны определить вещество в избытке и в недостатке. Работать будем с недостатком.
0.235/1 = 0.235
0.5/1 = 0.5
Сравним полученные значения. То, что меньше - в недостатке.
0.235 меньше 0.5
Вывод: работаем с Ca(OH)2.
4) По пропорции найдем кол-во вещ-ва осадка:
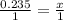
х = 0.235
Значит, кол-во вещества осадка равно 0.235 моль
5) Рассчитаем массу осадка.
m = M * n = 100 г/моль * 0.235 моль = 23.5 г.
====================
ответ: 23.5 г
In(OH0)3
Объяснение: