1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
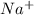

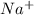
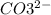

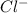
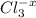


Для того, щоб визначити об'єм кисню, який витрачається при згоранні 6,2 г фосфору, спочатку потрібно визначити хімічну реакцію згорання і балансувати її рівняння.
Реакція згорання фосфору у кисні має наступний вигляд:
P₄ + 5O₂ → 2P₂O₅
Для того, щоб збалансувати це рівняння, потрібно помножити коефіцієнти реагентів та продуктів на певні числа:
P₄ + 5O₂ → 2P₂O₅
1 5 2
Отже, для згорання 1 мол фосфору необхідно 5 мол кисню. Молярна маса фосфору дорівнює 30,97 г/моль. Таким чином, маса 6,2 г фосфору дорівнює:
6,2 г / 30,97 г/моль = 0,2 моль фосфору
Отже, для згорання 0,2 моль фосфору потрібно:
0,2 моль * 5 моль кисню/моль фосфору = 1 моль кисню
Об'єм 1 моля газу за нормальних умов (0 °C, 1 атм) дорівнює близько 22,4 л. Тому об'єм кисню, який витрачається при згоранні 6,2 г фосфору, дорівнює:
1 моль * 22,4 л/моль = 22,4 л
Тепер потрібно визначити, скільки грамів оксиду фосфору (5) утворюється в результаті згорання 6,2 г фосфору. Молярна маса P₂O₅ дорівнює 141,94 г/моль. Оскільки у реакції утворюється 2 моля P₂O₅ на 1 моль P₄, то можна обчислити масу P₂O₅ за до наступного розрахунку:
0,2 моль P₄ * (2 моль P₂O₅/1 моль P₄) * (141,94 г/моль) = 56,78 г P₂O₅
Отже, в результаті згорання 6,2 г фосфору утворюється 56,78 г оксиду фосфору (5).