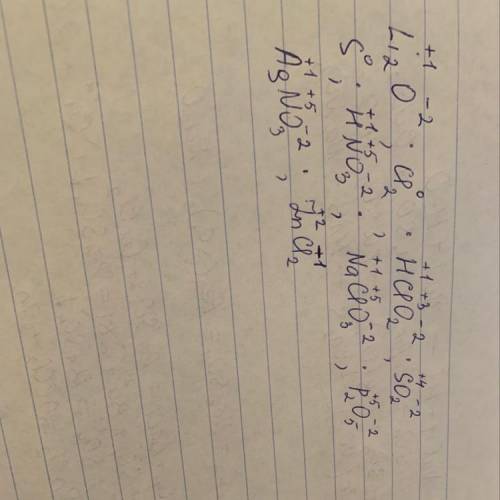
сначала напишем уравнение взаимодействия серной кислоты с гидроксидом алюминия : H2so4+al(oh)3=Al2(so4)3+h2o
второе действие нужно найти массу серной кислоты через пропорцию:
280-100%
x-20% тогда х=56
теперь можем это число разделить на массу серной кислоты
56/98=0.6
также находим массу гидраксида алюминия через пропорцию:30-100%
x-7%
x=2.1/73=0/02 Это задача на избыток и недостаток ,мы видим что цифра 0,02 меньше поэтому умножаем на массу соли :mrAl2(so4)3=342
342*0.02=9,83
Объяснение:могут быть и ошибки при решении
Объяснение:
Кристаллическая решетка — это пространственное расположение частиц в веществе (молекул, атомов, ионов).
Решетки бывают атомные, молекулярные, металлические и ионные. Ионная кристаллическая решетка в своих узлах имеет попеременное расположение положительно и отрицательно заряженных ионов. Такая решетка встречается у веществ с ионным типом связи, то есть у основных оксидов, солей и оснований. Например: оксид кальция, хлорид натрия, гидроксид меди. Вещества с ионной решеткой всегда твердые, тугоплавкие.
1) Li2O
Степени окисления: Li(+1); O(-2)
2) Cl2
Степень оксисления: Cl2(0)
3) HClO2
Степени окисления: H(+1); Cl(+3); O(-2)
4) SO2
Степени окисления: S(+4); O(-2)
5) S
Степень оксисления: S(0)
6) HNO3
Степени окисления: H(+1); N(+5); O(-2)
7) NaClO3
Степени окисления: Na(+1); Cl(+5); O(-2)
8) P2O5
Степени окисления: P(+5); O(-2)
9) AgNO3
Степени окисления: Ag(+1); N(+5); O(-2)
10) ZnCl2
Степени окисления: Zn(+2); Cl(-1)