1. В растворе массой 250 г содержится 30 г сахара. Рассчитайте массовую долю
сахара в растворе (в %).
2. Какая масса нитрата калия (в граммах) содержится в его 13%-м растворе массой
300г. Укажите ответ с точностью до целых.
3. Рассчитайте массу 15%-го раствора сульфата меди, содержащего 18 г
растворенного вещества. Запишите число с точностью до целых.
4. Раствор массой 130 г содержит 10 г серной кислоты. Рассчитайте долю серной
кислоты в этом растворе (в %). Запишите число с точностью до десятых.
5. Чему равна масса гидрокарбоната натрия в 50 г его 15-ного раствора. Запишите
число с точностью до десятых.
6. Какова масса хлорида натрия с концентрацией 17%, содержащего 45 г
растворенного вещества. Запишите число с точностью до десятых.
7. Рассчитайте массу у нитрата меди (II) в 130 г его 15% раствора. Запишите число с
точностью до десятых.
 моль
моль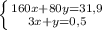
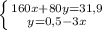

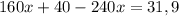

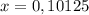 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)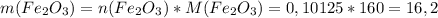 г
г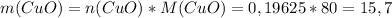 г
г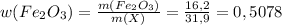 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)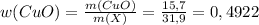 или 49,22%
или 49,22%
а) аммиак реагирует :
соляная кислота NH₃ + HCl = NH₄Cl
гидроксид натрия NH₃+ 3NaOH=Na₃N + 3H₂O
кислород (без участия катализатора)
N⁻³H₃ +O₂⁰ → N₂⁰ + H₂O⁻²
N⁻³ -3e⁻ → N⁰ 3 4
12
2O⁰ +2x2e⁻→ 2O⁻² 4 3
N⁻³ восстановитель
O⁰ окислитель
4NH₃ +3O₂ = 2N₂ + 6H₂O
серная кислота 2NH₃ + H₂SO₄=(NH₄)₂SO₄
оксид меди (II)
N⁻³H₃ + Cu⁺²O → Cu⁰ + N₂⁰+H₂O
N⁻³ -3e⁻→ N⁰ 3 2
6
Cu⁺² +2e⁻→ Cu⁰ 2 3
N⁻³ восстановитель
Cu⁺² окислитель
2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O
б) аммиак не реагирует :
азот NH₃ +N₂≠
хлорид натрия NH₃ +NaCI≠
2)
Дано:
m(NH₄CI)=10,5г.
Ca(OH)₂
Vm=22,4л./моль
(н.у.)
V(NH₃)-?
1. Определим молярную массу хлорида аммония и его количество вещества в 10,5г.:
M(NH₄CI)=14+4+35,5=53,5
n(NH₄CI)=m(NH₄CI)÷M(NH₄CI)
n(NH₄CI)=10,5÷53,5=0,196моль округлим 2моль
2. Запишем уравнение реакции:
2NH₄Cl +Ca(OH)₂ = CaCl₂ + 2NH₃↑ + 2 H₂O
а) по уравнению реакции из 2моль хлорида аммиака образуется 2моль аммиака
б) по условию задачи дано тоже 2моль хлорида аммония, значит и аммиака образуется 2моль.
n(NH₃)=2моль
3. Определим объем аммиака колисеством вещества 2моль:
V(NH₃)=n(NH₃)xVm
V(NH₃)=2мольх22,4л./моль=44,8л.
4. ответ: из хлорида аммония массой 10,5г с гидроксидом кальция образуется 44,8л. аммиака.
3) В трех пронумерованных склянках без этикеток находятся: сульфат натрия Na₂SO₄, сульфат аммония (NH₄)₂SO₄ и нитрат натрия NaNO₃.
(предполагаем, что это растворы, если твердые соли то переводим их в раствор)
1. Отольем из каждой склянки немного веществ.
2. Во все пробирки прильем концентрированный раствор гидроксида натрия. В той пробирке, где почувствуется запах аммиака находится сульфат аммония. Склянку под этим номером подписываем и отставляем.
(NH₄)₂SO₄ + 2NaOH(конц.) = Na₂SO₄ + 2NH₃↑ + 2H₂O
3. Из оставшихся склянок отольем в пробирки немного веществ. В каждую пробирку прильем хлорид бария. В той пробирке, где образуется белый осадок находтся сульфат натрия. Склянку подписывем и отставляем.
Na₂SO₄ + BaCI₂ = 2NaCI + BaSO₄↓
4. Чтобы убедиться в том, что в склянке нитрат натрия. К пробе раствора из этой склянки добавляем немного концентрированной серной кислоты, кусочек медной стружки и нагреваем. Образуется голубой раствор нитрата меди и выделяется бурый газ оксид азота(IV):
4NaNO₃+ Cu + 2H₂SO₄(конц.) = Cu(NO₃)₂ + 2NO₂ ↑ + 2Na₂SO₄ + 2H₂O
Таким образом, мы определили все три предложенные растворы.