Задание 1: элемент подгруппы галогенов, атомы которого образуют вещество с наиболее выраженными неметаллическими свойствами, - это иод, бром, хлор, фтор.
Составьте схему строения его атома этого элемента и формулу его вещества.
Задание 2. Допишите уравнения реакций:
H2 + F2 --- HCl + AgNO3 --- CuS + O2 --- SO2 + CuO
Для окислительно-восстановительных реакций составьте электронный баланс, для реакций ионного обмена – ионные уравнения.
Задание 3. Охарактеризуйте реакцию по изученным признакам: 2HgO = 2Hg + O2 - Q
Задание 4. Запишите два предложения, в одном из которых говорится о кислороде как о веществе, в другом – как о химическом элементе.
Воспользуемся формулой: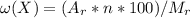
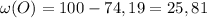 %
%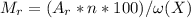 , здесь Mr - молярная масса вещества, Ar - атомная масса элемента,входящего в вещество, n - число атомов элемента в веществе, w(x) - процентное содержание элемента в веществе
, здесь Mr - молярная масса вещества, Ar - атомная масса элемента,входящего в вещество, n - число атомов элемента в веществе, w(x) - процентное содержание элемента в веществе
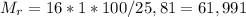 г/моль
г/моль
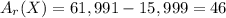 г/моль
г/моль
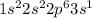
Из формулы выразим :
Найдём молярную массу вещества:
Молярная масса складывается из атомных масс - вычтем атомную массу кислорода, чтобы найти атомную массу интересующего нас металла:
Но, так как сказано, что элемент первой группы, значит в оксиде число его атомов =2, т.е чтобы получилась атомная масса 1 атома, разделим полученное значение на 2:
46/2 = 23 г/моль
Смотрим по таблице Менделеева, да, это натрий(Na) - одиннадцатый элемент.
Атом натрия имеет следующую конфигурацию:
Оксиду натрия Na2O соответствуем гидроксид NaOH, который проявляет типичные основные свойства:
NaOH + HCl = NaCl + H2O
NaOH + AL(OH)3 = Na[Al(OH)4]
NaOH + CuSO4 = Cu(OH)2 + Na2SO4