Составим уравнение реакции серы с алюминием: 2Al +3S =Al2S3 Теперь составим уравнение реакции сульфида алюминия с соляной кислотой: Al2S3 +6HCl =2AlCl3 +3H2S Теперь переведем объем сероводорода в моль, разделив объем на молярный объем: 1.008/22.4 =0.045 Из уравнения реакции мы видим, что на 3 моль сероводорода приходится 1 моль сульфида алюминия. Значит, что сульфида в образце было 0.045/3 =0.015 моль. Теперь найдем массу сульфида, умножив количество вещества на молярную массу: 0.015*150 =2.25 грамма. Теперь вычтем : 3.21-2.25 =0.96 грамма. Если бы в избытке был алюминий, то он бы растворился в избытке соляной кислоты, значит, в избытке в смеси сера. Теперь найдем ее массовую долю в сульфиде алюминия, разделив ее молярную массу, умноженную на коэффициент в веществе на молярную массу вещества. (32*3)/150 =0.72 Теперь найдем общую массу серы в смеси: 0.96 +2.25*0.72 =2.58 грамма. Соответсвенно масса алюминия равна: 3.21-2.58 =0.63 Теперь найдем массовую долю алюминия, разделив его массу на массу смеси: 0.63/3.21 =0.2 И серы: 2.58/3.21 =0.8
ответ: больше массовая доля кислорода в азотной кислоте, ω(O)= 76%.
Объяснение:
ω(Э)=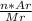 , где n - чисто атомов элемента в молекуле, Ar - относительная атомная масса элемента, Mr - относительная молекулярная масса.
, где n - чисто атомов элемента в молекуле, Ar - относительная атомная масса элемента, Mr - относительная молекулярная масса.
Ar(O)=16
Азотная кислота (HNO3):
Mr(HNO3) = 1+14+16*3=63
ω(O)=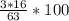 %
%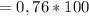
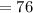 %
%
Проверка:
ω(N)=14*100%/63=22%
ω(H)=1*100%/63=2%
22+76+2=100% - все верно.
Фосфорная кислота (H3PO4):
Mr(H3PO4)=1*3+31+16*4=98
ω(O)=4*16*100%/98=65%
Проверка:
ω(P)=31*100%/98=32%
ω(H)=3*100%/100=3%
65+32+3= 100% - все верно.