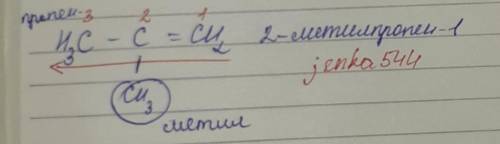Li2O , Na2O , K2O , Rb2O , Cs2O .
Все оксиды обладают ярко выраженными основными свойствами.
В ряду от оксида лития к оксиду цезия основные свойства усиливаются.
Оксиды щелочных металлов взаимодействуют с:
водой:
Li2O+H2O=2LiOH ,
Na2O+H2O=2NaOH ;
кислотными оксидами:
K2O+CO2=K2CO3 ;
кислотами:
K2O+2HCl=2KCl+H2O
Объяснение:
Гидроксиды
Щелочные металлы образуют основные гидроксиды (основания):
LiOH ,
NaOH (техническое название — едкий натр, или каустическая сода),
KOH (техническое название — едкое кали),
RbOH ,
CsOH .
Сила оснований увеличивается от гидроксида лития LiOH к гидроксиду цезия CsOH .
Гидроксиды щелочных металлов являются сильными основаниями, растворимыми в воде. Общее их название — щёлочи.
Это белые кристаллические вещества.
2-метилпропен-1
Объяснение:
1. Выделяют в формуле наиболее длинную связь,содержащую двойную связь. Нумерацию атомов начинают с того конца,к которому ближе двойная связь. В нашем случае,будем выбирать прямолинейно длинную связь,ведь кривлять её нет смысла. В основе у нас лежит пропен, из трёх атомов углерода. Нумеруем с правого конца и влево,потому что двойная связь там ближе.
2. В начале названия соединения указывают цифрой,при каком атоме углерода находится заместитель. У нас на втором атоме углерода идёт разветвление и радикал один называется метил. Так и пишем, 2-метилпропен.....
3. После названия длинной цепи обозначают положение двойной связи при том атоме углерода,от которого начинается двойная связь.
Получается у нас 2-метилпропен-1.
*Название радикалов и алкенов образуются от первых представителей -алканов. В случае с радикалами,суффикс ан заменяется на ил. Получается:метил,этил,пропил....и т.д . В случае с алкенами,суффикс ан заменяется на ен. Получается:пропен,пентен,гексен....и т.д.