Объём находится по формуле 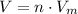 , где
, где
n-колличество
V-Объём
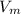 -молярный объём (у газов всегда 22,4 л/моль)
-молярный объём (у газов всегда 22,4 л/моль)
Количество находим по формуле 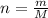 , где n-колличество,
, где n-колличество,
m-масса, M- молярная масса (её мы находим по таблице Менделеева)
Решение.
1) n(CO₂)=4,4г:(12+16·2)г/моль=0,1моль
2) V(CO₂)=0,1моль·22,4л/моль=2,24л
ответ: 2,24л
опыт 1. Получение раствора гидроксида кальция. Небольшой кусочек мела СаСОз захватить тигельными щипцами и прокаливать 3-5 мин, охладить, поместить в фарфоровую чашку или пробирку и, смочив несколькими каплями воды, наблюдать за изменениями. После этого прибавить 2-3 капли раствора фенолфталеина и сделать вывод о характере раствора. Написать уравнения реакций, происходящих при прокаливании СаСОз и растворении продукта прокаливания.
Опыт 2. Взаимодействие основного оксида с водой» К небольшому количеству оксида магния в пробирке прилить дистиллированной воды и взболтать. Прибавить к реакционной смеси 2-3 капли раствора фенолфталеина. Что наблюдается? Написать уравнения реакции.
Опыт 3. Получение нерастворимых в воде гидроксидов. В две пробирки налить по 1-2 мл раствора солей FeCl3 и CuSO4 и прибавить приблизительно равный объем раствора гидроксида натрия. Что наблюдается? Испытать в воде, кислоте и щелочи растворимость полученных осадков. Написать уравнения реакций.
2СН3COONa + H2SO4 = 2CH3COOH + Na2SO4 2NaCl + H2SO4(конц) = Na2SO4 + 2HCl↑
Объяснение:
M(Co2)=12+16+16=44г/моль
ню(Сo2)=4,4г/44г/моль=0,1моль
тогда объем(СO2) равен 0,1 * 22,4обьем авагадра =2,24л