1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
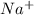

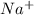
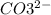

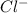
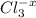


C2H5OH ⇒ CH3COH + Н2. (уксусный альдегид запишите правильно, показав двойную связь, такая запись, как у меня, неправильна. Просто тут не имею возможности правильно написать). Над стрелочкой напишите ещё катализатор Cu и температуру.
1. Нам дан раствор альдегида массой 400г. Это значит, что масса альдегида и воды в сумме составляет 400г (поэтому и раствор). Но нам для расчётов нужна масса чистого альдегида, то есть надо узнать, сколько же этого альдегида находится в растворе. Для этого умножим массу раствора на массовую долю альдегида.
m(CH3COH) = 400г * 0,15 = 60г. (т.к. нам дано 15 процентов, надо разделить их на сто процентов, чтобы производить расчёты).
2. теперь находим кол-во вещества альдегида
n = m/M, где М - молярная масса альдегида, равна она 44г/моль
n = 60/44 = 1,36 моль
3. По уравнению видно, что n спирта равно n альдегида, поэтому масса спирта равна = n(спирта) * M(спирта). M спирта равна 46 г/моль.
m = 1,36 моль * 46 г/моль = 62,56г.