
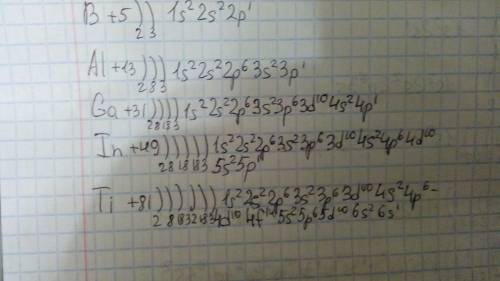
Как-то так:
Тема: ПОЛУЧЕНИЕ ГИДРОКСИДА ЦИНКА И ИЗУЧЕНИЕ ЕГО АМФОТЕРНЫХ СВОЙСТВ
Цель: получить амфотерный гидроксид цинка и изучить его взаимодействовать с кислотами и щелочами.
Ход работы:
1. Получение гидроксида цинка.
В пробирку налейте раствор соли цинка и осторожно по каплям добавьте к нему раствор щелочи до образования белого осадка. Вы получили нерастворимое основание гидроксид цинка.
2. Изучение амфотерных свойств гидроксида цинка.
Полученный осадок разделите на две части в разные пробирки.
а) К осадку гидроксида цинка в первой пробирке добавляйте соляную или серную кислоту (избыток). Обратите внимание на быстрое растворение осадка. Дополните рисунок.
Составьте уравнение реакции, сделайте вывод о том, какие свойства (основные или кислотные) проявляет гидроксид цинка в данной химической реакции.
Запишите уравнение химической реакции
Zn(OH)₂ + 2HCl = ZnCl₂ + 2H₂O
Вывод. В реакции с кислотой гидроксид цинка проявляет основные свойства.
б) Ко второй части осадка гидроксида цинка прибавьте раствор щелочи (избыток) до его полного растворения.
Уравнение химической реакции:
H₂ZnO₂ + 2NaOH = Na₂ZnO2 + 2H₂O при спекании
ИЛИ
H₂ZnO₂ + 2NaOH = Na₂[Zn(OH)₄] в растворе
Гидроксид цинка в этой химической реакции проявляет кислотные свойства.
Вывод. Гидроксид цинка является амфотерным, потому что обладает двойственностью функций. То есть проявляет как кислотные, так основные свойства в химических реакциях.
С + О2 => СO2 + 402 кДж
Объяснение:
2400г углерода - это 200молей. Значит при сгорании одного моля выделится 80400/200 = 402 кДж
И уравнение реакции будет следующим:
С + О2 => СO2 + 402 кДж