Швидкість реакції характеризує зміну кількості речовини її компонентів (реагентів чи продуктів) за певний проміжок часу.
Нам відомо, що реакції проходили однакову кількість часу, тож швидкість реакції буде більша в тому реакторі, в якому за цей проміжок утворилася більша кількість речовини вуглекислого газу.
1 реактор:
Формула кількості речовини:
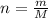
Знайдемо молярну масу вуглекислого газу:
M (CO₂) = 12 + 2 * 16 = 44 (г/моль).
Тепер знайдемо кількість речовини:
n (CO₂) = 6,6 : 44 = 0,15 (моль).
2 реактор:
Формула кількості речовини:
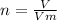
Vm (молярний об'єм) газів за нормальних умов дорівнює 22,4 л\моль.
Знайдемо кількість речовини:
n (CO₂) = 4,48 : 22,4 = 0,2 (моль).
Порівняємо кількості речовин вуглекислого газу, що виділився в першому і другому реакторах:
n₁ < n₂
Значить, в другому реакторі швидкість реакції більша.
Відповідь: у другому.
2. m(р-ра) = 1400 g
W(H2SO4) = 7%
m(H2SO4) - ?
m(H2SO4) = 0.07 * 1400 = 98 g
(если надо найти кол-во вещества H2SO4, то n(H2SO4) = 98 / 98 = 1 mol, просто формулировка двусмысленная, я из другой страны)
3. m(Na) = 4.6 g
m(H2O) = 200 ml = 200 g [g = ml, ТОЛЬКО ДЛЯ ВОДЫ!]
n(Na) = 4.6 / 23 = 0.2 mol
n(H2O) = 200 / 18 = 11.1 mol
0.2 mol 11.1 mol
2Na + 2H2O = 2NaOH + H2
2 mol 2 mol
Na - в недостатке, ищем по Натрию.
0.2 mol x mol
2Na + 2H2O = 2NaOH + H2
2 mol 2 mol
2:0.2 = 2:x
2x = 0.4
x = 0.2
m(NaOH) = 0.2 * 40 = 8 g
W(NaOH) = 8 / 204.6 = 0.039 = 3.9%
4. m(р-ра) = 150 g
W(KNO3) = 20%
m(H2O) = 50 g
W1(KNO3) - ?
m(KNO3) = 0.2 * 150 = 30 g
W1(KNO3) = 30 / 200 = 15 / 100 = 15%
С + О2 = СО2
теоретическое количество углекислого газа:Vт(CO2) = V(CO2)/выход = 10,64/0,95 = 11,2 л.
n(CO2) = Vт(СО2)/Vm = 11,2/22,4 = 0,5 моль
По уравнению n(C) = n(CO2) = 0,5 моль
m(C) = n(C)*M(C) = 0,5*12 = 6 г - столько углерода сгорело
W(C) = m(C)/m(угля) = 6/8 = 0,75 или 75%
массовая доля примесей в угле равна 100% - 75% = 25%.