Відповідь:
1,2,3,4 - в примечании.
Пояснення:
5. Дано:
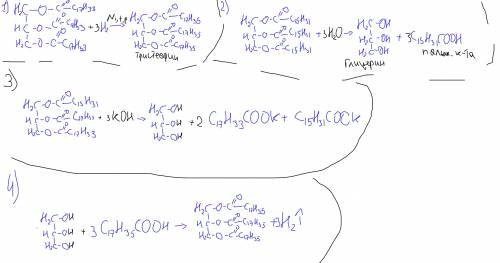
m(C₃H₈O₃)=9.2 g | (C₁₇H₃₅COO)₃C₃H₅ + H₂O →
____________________|→C₃H₈O₃ + 3C₁₈H₃₆O₂
m((C₁₇H₃₅COO)₃C₃H₅)-? | Соотношение моль → 1:1
n(C₃H₈O₃)=9.2/92=0.1 моль
n(C₃H₈O₃)=n((C₁₇H₃₅COO)₃C₃H₅)=0.1 моль
m((C₁₇H₃₅COO)₃C₃H₅)=0.1*530=53 g
6. Дано:
m(C₁₈H₃₄O₂)=64 г | 64 г - 100%
w(примесей)=12 % | х г - 100%-12% (=88%)
_______________| Х=64*88/100%=56.32 г
m(C₅₇H₁₀₄O₆)-? | 3C₁₈H₃₄O₂ +C₃H₈O₃ →→+(H₂SO₄)→→ C₅₇H₁₀₄O₆ +3 H₂O . Соотношение → 3:1
3n(C₁₈H₃₄O₂)=n(C₅₇H₁₀₄O₆)=3*m(C₁₈H₃₄O₂)/Mr(C₁₈H₃₄O₂)=3*56.32/282=0.596 моль
m(C₅₇H₁₀₄O₆)=0.596*884=526,864 g
*Поставьте лучшее
ответ: Да, можно, так как кислотность среды определяется количеством катионов водорода или протонов. Чем легче молекула отдает протон, тем легче происходит диссоциация в растворе и тем сильнее происходит протонирование воды, и тем самым происходит повышение кислотности. Это очень хорошо видно на водородных соединениях галогенов. Сила кислот будет увеличиваться от HF к HI, так как радиус между ядрами у йодоводорода больше и тем легче он отдает протон. Экспериментально выяснено, что йодоводородная кислота сильнее и это ещё раз подтверждает то, что, чем легче отдаётся протон тем сильнее и кислота, и кислотность её водных растворов .
1 - реакция не идёт
2. 2HNO3 + K2SiO3 => H2SiO3 + 2KNO3
2H(+) + SiO3(2-) => H2SiO3
3. CuO + H2SO4 => CuSO4 + H2O
CuO + 2H(+) => Cu(2+) + H2O
4. 3Ba(OH)2 + 2AlCL3 => 2Al(OH)3 + 3BaCL2
Al(3+) + 3OH(-) => Al(OH)3
5. MgSO4 + BaCL2 => BaSO4 + MgCL2
SO4(2-) + Ba(2+) => BaSO4