 углерод имеет степень окисления -1. И при этом, углерод имеет валентность II, либо IV.
углерод имеет степень окисления -1. И при этом, углерод имеет валентность II, либо IV.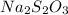 , где сера имеет степень окисления +4, имеет в своем строении 2 атома серы с разной валентностью (см. вложения). Сера может иметь валентность II, IV и VI. Здесь же, как можно заметить, только VI и II. Поэтому здесь так же с.о. не совпадает с валентностью.
, где сера имеет степень окисления +4, имеет в своем строении 2 атома серы с разной валентностью (см. вложения). Сера может иметь валентность II, IV и VI. Здесь же, как можно заметить, только VI и II. Поэтому здесь так же с.о. не совпадает с валентностью.
54% Zn, 46% Fe
Объяснение:
Общее количество полученной меди равно 12,8:64 = 0,2 моль. При этом и цинк, и железо уходят в раствор.
Zn + CuCl2 --->ZnCl2 + Cu
Fe + CuCl2 ---> FeCl2 + Cu
С одной стороны, изменение массы смеси металлов, помещённой в раствор, определяется разностью молярных масс металлов: 65 г/моль - 56 г/моль = 9 г/моль. С другой стороны, количество полученной меди равно сумме количеств металлов, ушедших в раствор, значит, изменение массы исходной смеси равно 65*0,2 - 12,1 = 0,9 грамма.
Следовательно, исходная смесь содержала 0,9:9 = 0,1 моль цинка и 0,2 - 0,1 = 0,1 моль железа.
Массовые доли металлов в смеси равны:
W(Zn) = 0,1*65/12,1 = 0,54, или 54%
W(Fe) = 0,1*56/12,1 = 0, 46, или 46%