Задача 1. Запишите уравнения реакций, при которых можно получить кислород в лаборатории.
В лаборатории кислород можно получить в результате термического разложения некоторых солей:
2KClO3 = 2KCl + 3O2 (в присутствии MnO2),
2KMnO4 = K2MnO4 + MnO2 + O2,
2KNO3 = 2KNO2 + O2,
или в результате каталитического разложения пероксида водорода (катализатор MnO2):
2Н2О2 = 2Н2О + О2,
или электролизом воды:
2H2O 2H2 + O2.
Задача 2. При разложении 97,65 г оксида ртути (II) образовалось 4,48 л кислорода (н. у.). Вычислите долю разложившегося оксида ртути (II) (в мас. %).
Дано:
m (HgO) = 97,65 г
V (O2) = 4,48 л
M (HgO) = 217 г/моль
Найти:
ω (HgO)
Запишем уравнение реакции разложения оксида ртути (II):
2HgO = 2Hg + O2.
Вычислим количество образовавшегося кислорода:
,
моль.
По уравнению реакции разложения из 2 моль оксида ртути (II) образуется 1 моль кислорода, то есть соотношение n (HgO) : n (O2) = 2 : 1, по условию задачи образовалось 0,2 моль кислорода, следовательно разложилось 0,4 моль оксида ртути (II).
Вычислим массу разложившегося оксида. Количество вещества связано с массой вещества соотношением:
.
Тогда масса оксида ртути (II) равна:
m (HgO) = n (HgO) · M (HgO) = 0,4 · 217 = 86,8 (г).
Определим массовую долю разложившегося оксида:
(%).
ответ: ω (HgO)разл. = 88,9 %.
1) В пределах одной группы металлические свойства возрастают при увеличении порядкового номера элемента. Это связано с увеличением радиуса атома и более легким отхождением электронов от ядра.
ОТВЕТ: а)
2) Имея только один электрон на внешнем энергетическом уровне, элемент может иметь валентность только 1, соответственно может содержать только одну ОН группу и два атома на кислород в окисде.
ОТВЕТ: в)
3) Как уже было сказано в первом номере, в одной группе радиус атома увеличивается с увеличением его порядкового номера.
ОТВЕТ: г)
4) Щелочные металлы невероятно активны, и всячески стремятся перейти в устойчивую для себя форму иона, с зарядом +1. Поэтому в свободной форме в природе не встречаются и окислительных свойств не проявляют почти совсем, а восстановительных в степени окисления +1 в принципе не могут проявлять, но что правда про них, это то, что их действительно почти все можно спокойно резать ножом и намазывать на хлеб, главное потом не есть)
ОТВЕТ: в)
5) Реакция натрия с водой невероятно экзотермична. Натрий как бешеный носится по поверхности и искрит. В то же время это является реакцией замещения водорода на натрий. Продуктом реакции является щелочь.
ОТВЕТ: в)
6) Основные свойства щелочей тем выше, чем активнее металл, входящий в соединение наиболее активным металлом является литий.
ОТВЕТ: а)
7) С раствором щелочи точно не могут взаимодействовать основные соединения. Могут лишь кислотные и амфотерные. Могут таже растворимые соли, если в результате реакции получается нерастворимвый гидроксид.
ОТВЕТ: б)
8) Соли натрия содержает его ионы. Ионы натрия окрашивают пламя горелки в желтый цвет.
ОТВЕТ: г)
9) Каустическая сода (она же едкий натр) - тривиальное название гидроксида натрия
ОТВЕТ: в)
10) Хлорид соединие вида 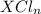 , сульфид
, сульфид 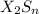 , гидрид
, гидрид 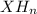 .
.
ОТВЕТ: в)
3KOH+H3PO4=K3PO4 +3H2O-обмена
CU+2HCL=CUCL2+H2 (газ)-замещения
2AL+3H2SO4=AL2(SO4)3+3H2-замещения
CACO3-> CAO+CO2 (t)-разложения