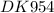Реакция полного сгорания бензола: 2 C₆H₆ + 15 O₂ = 12 CO₂ + 6 H₂O M(C₆H₆) = 12*6 + 6 = 78 г/моль M(O₂) = 2*16 = 32 г/моль 1 моль любого газа занимает объем 22,4 л Согласно уравнению реакции 2 моль бензола (2*78 г) реагируют с 15 моль кислорода (15*22,4 л): 2 C₆H₆ + 15 O₂ = 12 CO₂ + 6 H₂O 2*78 г 15*22,4 л 23,4 г х л
х = 23,4*15*22,4 / (2*78) = 50,4 л. O₂ 50,4 л чистого кислорода требуется для полного сгорания бензола. Однако в воздухе кислорода лишь приблизительно 20% по объему (1/5 часть). Значит, воздуха нужно в 5 раз больше: 50,4 * 5 ≈ 250 л ответ: 250 л.
{ Примечание. Округляем, потому что решение не очень точное, во-первых, по составу воздуха, во-вторых, молярный объем газов составляет 22,4 л/моль только для нормальных условий (н.у.) - давлении 1 атмосфера, температуре 0°С) }
Дано:
ω(H₂CO₃) = 3% = 0,03
ρ(р-ра H₂CO₃) = 1 гр/см³ = 1 гр/л
Кд(Н₂СО₃) = 3,5×10⁻⁵
Найти:
[H⁺] - ? α - ? pH - ?
1) Для начала мы найдем молярную концентрацию угольной кислоты:
M(H₂CO₃) = 1×2 + 12 + 16×3 = 2 + 12 + 48 = 62 гр/моль
Cm(H₂CO₃) = (1000 × ρ(р-ра H₂CO₃) × ω(H₂CO₃)) / M(H₂CO₃) = (1000 × 1 гр/л × 0,03) / 62 гр/моль = 30 гр/л / 62 гр/моль ≈ 0,48 моль/л ⇒ [H₂CO₃] = Cm(H₂CO₃) = 0,48 моль/л
2) Далее напишем про диссоциацию у угольной кислоты, потом находим концентрацию ионов водорода:
H₂CO₃ ⇄ H⁺ + HCO₃⁻
Так как [H⁺] = [HCO₃⁻], следовательно:
Кд(H₂CO₃) = ([H⁺]×[HCO₃⁻])/[H₂CO₃] = [H⁺]² / [H₂CO₃] , следовательно:
[H⁺] = √(Кд(H₂CO₃) × [H₂CO₃]) = √(3,5×10⁻⁵ × 0,48) = √(1,68×10⁻⁵) = √(16,8×10⁻⁶) ≈ 0,0041 моль/л ≈ 4,1×10⁻³ моль/л
3) Далее находим степень диссоциаций:
α = n/N = [H⁺] / [H₂CO₃] = 4,1×10⁻³ моль/л / 0,48 моль/л ≈ 0,0085 (или 0,85%)
4) Теперь находим pH у угольной кислоты:
pH = -lg[H⁺] = -lg(4,1×10⁻³) = -(0,61 + (-3)) = -(0,61 - 3) = -(-2,39) = 2,39
ответ: [H⁺] = 4,1×10⁻³ моль/л α = 0,0085 (или 0,85%)
pH = 2,39
Решено от :