Дано: m(SO₃) = 20 грамм, η(NaOH) = 12 % – концентрация раствора.
Уравнение реакции: SO₃ + 2NaOH → Na₂SO₄ + H₂O
молярная масса SO₃: М(SO₃) = 32 + 3·16= 32 + 48 = 80 г/моль,
молярная масса NaOH: М(NaOH) = 23 + 16 + 1 = 40 г/моль,
количество вещества оксида серы VI:
ν(SO₃) = m(SO₃) : М(SO₃) = (20 г) : (80 г/моль) =  = 0,25 моль.
= 0,25 моль.
SO₃ + 2NaOH → Na₂SO₄ + H₂O. На один моль оксида серы VI приходится два моля гидроксида натрия ⇒ ν(NaOH) = 2ν(SO₃) = 2·0,25 = 0,5 моль;
масса NaOH равна: m(NaOH) = М(NaOH)·ν(NaOH) = 40·0,5 = 20 грамм,
η(NaOH) = [m(NaOH) · 100%] : m(раствора) ⇒ масса раствора равна:
m(раствора) = [m(NaOH) · 100%] : η(NaOH) = 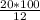 = 166,7 г
= 166,7 г
ответ: масса раствора равна 166,7 грамм
Объяснение:2 вопрос
алкан-сн4
алкен-с2н4
алкин-с2н2
3вопрос
внизу будет картинка
4 вопрос
алкены:Температуры плавления и кипения алкенов (упрощённо) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гептадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
алкин: Алкины плохо растворимы в воде, лучше — в органических
растворителях.
5 вопрос
Реакция горения.
Все алканы горят. При этом образуются углекислый газ и вода и выделяется большое количество тепла:
Реакции замещения.
Алканы реагируют при освещении с галогенами (хлором и бромом). При этом постепенно происходит замещение атомов водорода в молекуле алкана на атомы галогена:
Реакции разложения.
При сильном нагревании алканы разлагаются на уголь и водород:
алкен: картинка ниже
алкин :картинка ниже