1)Ковалентная связь это химическая связь которая образуется из за образования общих электронных пар у атомов
Образуется между атомами неметалических элементов
2)фото
3) одинарная связь когда 1 общая электронная пара
двойная когда 2
тройная когда 3
4)расстояние между атомами в молекуле
5)ковалентная неполярная это в простых веществах между одинаковыми атомами напр в O2 или F2
потому что у одинаковых атомов одинаковая электронегативность и электронная пара одинаково принадлежит обоим атомам
6)ковалентная полярная между атомами разных элементов напр H2O
потому что у атомов разная электронегативность
7)электронегативность это атомов оттягивать к себе электроны других атомов
8) как со фтором только возьми H2O
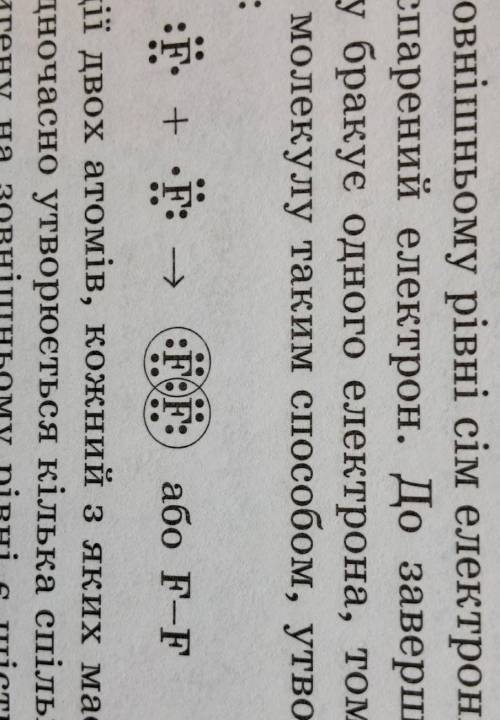
Реакции изменения окраски раствора:
{FeCl_ {3} + 3KCNS Fe (CNS) _ {3} + 3KCl}{FeCl_3 + 3KCNS Fe(CNS)_3 + 3KCl } - тиоцианат железа (III) красного цвета
{2K_ {2} CrO_ {4} + H_ {2} SO_ {4} \H_ {2} SO_ {4} + K_ {2} Cr_ {2} O_ {7} + H_ {2 } O}ь{2K_2CrO_4 + H_2SO_4 H_2SO_4 + K_2Cr_2O_7 + H_2O } - дихромат калия оранжевого цвета
{Pb (NO_ {3}) _ {2} + 2KI \ PbI_ {2} \ + 2KNO_ {3}{Pb(NO_3)_2 + 2KI \ PbI_2 + 2KNO_3 } - в осадок выпадает йодид свинца (II) желтого цвета {NiSO_ {4} + 2NaOH Ni (OH) _ {2} + Na_ {2} SO_ {4}{NiSO_4 + 2NaOH Ni(OH)_2 + Na_2SO_4 } - в осадок выпадает гидроксид никеля зеленого цвета
{CuSO_ {4} + 2NaOH Cu (OH) _ {2} + 2Na_ {2} SO_ {4} {CuSO_4 + 2NaOH Cu(OH)_2 2Na_2SO_4 } - в осадок выпадает гидроксид меди (II) голубого цвета
{Cu (OH) _ {2} + 4NH_ {4} OH \ [Cu (NH_ {3}) _ {4}] (OH) _ {2} + 4H_ {2} O} {Cu(OH)_2 + 4NH_4OH [Cu(NH_3)_4](OH)_2 + 4H_2O } - аммиакаты меди (II) темно-синего цвета
{CoCl_ {2} + 2KCNS \ Co (CNS) _ {2} + 2KCl}{CoCl_2 + 2 KCNS
Co(CNS)_2 + 2KCl } - тиоцианат кобальта (II) фиолетового цвета
Объяснение:
Тоесь цвет зависит от соединения!
Объяснение:
Задача 1
Молярная масса ацетилена (С2Н2) равна 26 г/моль.
Найдем какое количества вещества соответствует 60 л ацетилена.
60 л : 22,4 л/моль = 2,68 моль
Найдем массу 60 л ацетилена 26 г/моль х 2,68 моль ≈ 70 г
Задача 2.
Молярная масса метана 16 г/моль. Тогда метан массой 160 г соответствует количеству вещества 10 моль.
1 моль любого газа при н.у. занимают объем 22,4 л А 10 моль метана займут объем 224 л
Задача 3.
Определить молекулярную массу вещества, относительная плотность которого по водороду равна 13. Относительная молекулярная масса вещества составит 13 х 2 = 26. Из известных газов такую плотность будет иметь ацетилен С2Н2
Молекулярная масса ацетилена равна 26.