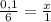
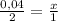
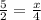
Объяснение:
К гидроксиду алюминия добавили раствор серной кислоты массой 24,5г. Какая масса гидроксида алюминия вступила в реакцию?
Запишем уравнение реакции между гидроксидом алюминия и серной кислотой:
2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 3 H2↑
Молярная масса гидроксида алюминия равна 78 г/моль.
Молярная масса серной кислоты равна 98 г моль.
Определим, какому количеству вещества соответствует серная кислота массой 24,5 г
24,5 г : 98 г/моль = 0,25 моль.
0,25 моль
2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 3 H2↑
Чтобы по уравнению реакции определить какое количество вещества гидроксида алюминия с вступает в реакцию с 0,25 моль серной кислоты составим пропорцию
3 моль Н2SO4 2 моль Al(OH)3
0,25 моль Н2SO4 х моль Al(OH)3
х = ( 0,25 × 2) : 3 = 0,17 моль
Найдем массу гидроксида алюминия
m Al(OH)3 = 78 г/моль × 0,17 моль = 13,0 г округленно
1. 3
2. 1
3. 2
4. 2
5. 1
6. 1
7. 2
8. 2
9. 3
Объяснение:
8.2CH3COOH + CaO → (CH3COO)2Ca + H2O
9. 2CH3COOH + Mg → (CH3COO)2Mg + H2↑
V(H2) = 33,6 л
n(H2) = V:Vм = 33,6:22,4 = 1,5 моль
n(CH3COOH) = 2*n(H2) = 3 моль
m(CH3COOH) = n*M = 3*60 = 180 г