Добрый день) решить тест : 1. зависимость скорости реакции от: концентрации (давления) реагирующи веществ. 2. определите класс и назовите соединения. для всех оксидов и гидроксидов реакции, их соответствующий кислотно-основной характер. для кислых и основных солей запишите молекулярные и ионно-молекулярные уравнения реакций превращения их в средние соли: khso4, cus, cr2o3, niohcl, cl2o7, k2o, h2mno4, cu(oh)2, naoн, hbr. 3.составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворе между следующими веществами: - серной кислотой и нитратом бария; - гидроксидом меди (ii) и азотной кислотой; - нитратом меди (ii) и сульфидом натрия. 4. что такое электронное облако? составьте электронную формулу для атома элемента 56. 5. при восстановлении 6,50 г оксида образовалось 4,45 г металла. вычислите молярную массу эквивалентов металла и его оксида. какой это металл, если его валентность равна 3? 6. предсказать и проверить расчетами знак изменения энтропии при стандартных условиях при протекании следующих реакций: а) caco3(т) = сао(т) + со2(г); б) nh3(г) + нсl(ж) = nh4cl(т). 7. во сколько раз следует увеличить давление в системе, чтобы скорость реакции 2pf3(r) + o2(r) ↔ 2pof3(r) увеличилась в 1000 раз? 8. к 500 мл 32%-го раствора азотной кислоты (плотность 1,193 г/мл) прибавили 1л воды. чему равна массовая доля и молярная концентрация полученного раствора? 9. вычислите рн 3,12%-го раствора соляной кислоты, плотность которого равна 1,015 г/мл. 10. расставить коэффициенты в уравнении реакции hno2 + hcl + kmno4 → kno3 + mn(no3)2 + h2o + kcl naclo + nacn + h2o → nahco3 + nacl + n2 11. вычислить электродные потенциалы положительного и отрицательного электродов и эдс гальванического элемента. составить уравнение реакций, протекающих на электродах при работе гальванического элемента, суммарное уравнение реакции. cu│cuso4 (0,02м)║agno3 (2,0м)│ag 12. составить уравнения электродных реакций, протекающих при электролизе раствора cuso4, с растворимым медным анодом и нерастворимым графитовым анодом. рассчитать, сколько растворится меди на аноде при пропускании тока силой 10 а в течение 3 ч.
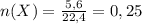 моль
моль
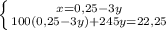
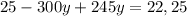

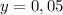
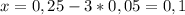
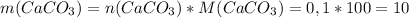 г
г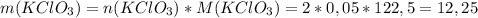 г
г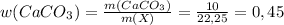 или 45%
или 45% или 55%
или 55%
NaHSO4 + NaOH =Na2SO4 +H2O
m(NaOH)=0.1*144*1.11=15,984г
n(NaOH)=15,984г/40г/моль=0,3996моль
Количество NaHSO4 тоже 0,3996моль
m(NaHSO4) =0,3996моль * 120г/моль= 47,952г
и это получается 40% (если не сульфат 60% - значит гидросульфат40% )
Значит масса смеси - 47,952г/0,4=119,88г - а масса сульфата в свою очередь 119,88г-47,952г=71,928г
NaHSO4+Ba(OH)2=BaSO4+NaOh+h2O
n(BaSO4) =0,3996моль
m(BaSO4) =0,3996моль*233.43 г/моль=93,28г
Na2SO4+Ba(OH)2=BaSO4+2NaOН
n(BaSO4) =n(Na2SO4)=71,928г/142г/моль=0,5моль
m(BaSO4)=0,5моль*233.43 г/моль=116.7г
m(BaSO4) общая =116.7г+93,28г=209.9г =210г
ответ подозрительный тк сказано округлить до десятых , а получается практически 210