1. 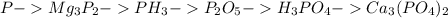
1) 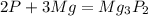
2) 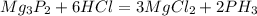
3) 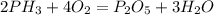
4) 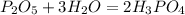
5) 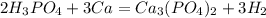
2. 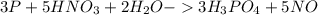
окисление 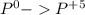 (-5e) восстановитель |5|3
(-5e) восстановитель |5|3
восстановление 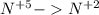 (+3e) окислитель |3|5
(+3e) окислитель |3|5
3. Дано:
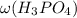 =80%
=80%
m(P)=31кг
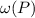 =5%
=5%
________________________________
m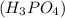 =?
=?
0,2 x
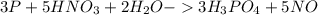
3кмоль 3кмоль
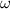 чист.(P)=100%-80%=20%
чист.(P)=100%-80%=20%
mчист.(P)=31кг*0,2=6,2кг
n(P)=6,2кг/31кг/кмоль=0,2кмоль
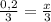 x=n(
x=n(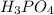 )=0,2кмоль
)=0,2кмоль
m(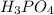 )=0,2кмоль*98кг/кмоль=19,6кг
)=0,2кмоль*98кг/кмоль=19,6кг
m(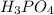 )=19,6кг*08=15,68 кг
)=19,6кг*08=15,68 кг
ответ: 15,68кг
Решение
1) Вычисли, какая масса гидроксида натрия образуется при взаимодействии оксида натрия с 7,2 г воды.
Na2O + H2O → 2NaOH
7,2 г х г
17,99 г --- 79.94 г.
M (H2O) = 1*2 + 15.99 = 17,99 г/моль
m (H2O) = 1* 17. 99 = 17,99 г
M (NaOH) = 22.98 + 15.99 + 1 = 39,97 г/моль
m (2NaOH) = 2 * 39.97= 79.94 г
х = 7,2 * 79,94 / 17,99
х = 31,99
ответ : m (2NaOH) = 31,99 г
2) Вычисли, какое количество вещества углекислого газа может прореагировать 20 г гидроксида натрия.
CO2 + 2NaOH → Na2CO3 + H2O
1 моль --- 2 моль – по уравнению количество
Х моль 20 г – по условию
M (NaOH) = 22.98 + 15.99 + 1 = 39.97 г/моль
Найдем количество гидроксида натрия:
n(NaOH) = m / M
n(NaOH) = 20 / 39.97 г/моль = 0.50 моль
тк в уравнении углекислого газа и гидроксида натрия соотношения 1:2
тогда n(CO2) = 0.50 : 2 = 0,25 моль
ответ: n(CO2) = 0,25 моль