ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
(1-(окисление азота) и (восстановление кислорода)
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
Неметаллические свойства элементов определяются атомов «принимать» электроны, т.е. проявлять при взаимодействии с атомами других элементов окислительные свойства. К неметаллам отно- сятся элементы с большой энергией ионизации, большим сродством к элек- трону и минимально возможным радиусом атома. Число неметаллов, известных в природе по сравнению с металлами отно- сительно невелико. Из всех элементов неметаллическими свойствами обла- дают 22 элемента, остальные элементы характеризуются металлическими свойствами. Неметаллы в основном располагаются в правой верхней части периоди- ческой системы. По мере заполнения наружной электронной оболочки чис- ло электронов на внешнем слое у неметаллов растет, а радиус уменьшается, поэтому они в большей степени стремятся присоединять электроны. В связи с этим неметаллы характеризуются более высокими значениями энергии ионизации, сродства к электрону и электроотрицательности по сравнению с атомами металлов и поэтому у них преобладают окислительные свойства, т.е атомов присоединять электроны. Особенно ярко окисли- тельные свойства выражены у атомов неметаллов 6 и 7 групп второго и третьего периодов. Самый сильный окислитель – фтор. Он окисляет даже воду и некоторые благородные газы: 2 F2 + 2 H2O = 4HF + O2 2 F2 + Xe = XeF4 Окислительные свойства неметаллов зависят от численного значения электроотрицательности атома и увеличиваются в следующем порядке: Si, B, H, P, C, S, I, Br, N, Cl, O, F Такая же закономерность в изменении окислительных свойств харак- терна и для простых веществ соответствующих элементов. Ее можно на- блюдать на примере реакций с водородом: 3 H2 + N2 = 2 NH3 (t, катализатор); H2 + Cl2 = 2 HCl (при освещении – hυ); H2 + F2 = 2 HF (в темноте - взрыв); Восстановительные свойства у атомов неметаллов выражены довольно слабо и возрастают от кислорода к кремнию: Si, B, H, P, C, S, I, Br, N, Cl, О Cl2 + O2 ≠ ; N2 + O2 = 2 NO (только при высокой t); S + O2 = SO2 ( при н.у.) Благородные газы в виде простых веществ одноатомны (Не, Nе, Аr и т.д.). Галогены, азот, кислород, водород как простые вещества существуют в виде двухатомных молекул (F2, С12, Вr2, I2, N2, О2, Н2). Остальные неме- таллы могут существовать при нормальных условиях, как в кристалличе- ском состоянии, так и в аморфном состоянии. Неметаллы в отличие от ме- таллов плохо проводят теплоту и электрический ток.
ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем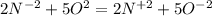 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам