Объяснение:
Дано:
ω(C) = 40,68%
ω(O) = 54,24%
ω(H) = 5,08%
-------------------------------
Найти:
CxHyOz - ?
1) Установим молекулярную формулу органического вещества:
M(C) = 12 гр/моль M(H) = 1 гр/моль M(O) = 16 гр/моль
n(C) = m(C)/M(C) n(H) = m(H)/M(H) n(O) = m(O)/M(H)
n(C) = 40,68 гр / 12 гр/моль = 3,39 моль
n(H) = 5,08 гр / 1 гр/моль = 5,08 моль
n(O) = 54,24 гр / 16 гр/моль = 3,39 моль
CxHyOz ⇒ x:y:z = 3,39:5,08:3,39 = 2:3:2
Простейшая молекулярная формула: C₂H₃O₂ - такого вещества не существует, поэтому молекулярная формула: C₄H₆O₄
2) Известно что при гидролизе этого вещества образуется CHO₂Na - это формиат натрия ⇒ вещество содержит остатки муравьиной кислоты. При гидролизе 1 моль вещество образуется 2 моль формиата натрия ⇒ вещество содержит 2 остатка муравьиной кислоты.
Структурная формула показано внизу там где фото:↓
3) Уравнение реакции гидролиза исходного вещества в растворе тоже показано внизу там где фото:↓
ответ: C₄H₆O₄
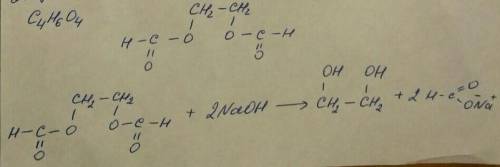
Объяснение:
1. Если к сульфату натрия Na₂SO₄, добавили раствор хлоридной кислоты HCI, то никакого газа не образуется. Вообще не произойдет химическая реакция, ТАК КАК Хлоридна кислота слабее серной кислоты и не сможет ее заместить в соли сульфату натрия.
2. Может в условии задачи дана соль сульфит натрия, тогда реакция произойдет и выделится сернистый газ.
Дано:
m(Na₂SO₃)=21,2г.
m(HCI)=15,0г.
Vm=22,4л./моль
V(SO₂)-?
1. Определим молярную массу сульфита натрия:
M(Na₂SO₃)=23x2+32+16x3=46+32+48=126 г./моль
2. Определим количество вещества сульфита натрия в 21,2г.:
n₁(Na₂SO₃)=m(Na₂SO₃)÷M(Na₂SO₃)=21,2г.÷126 г./моль=0,16моль
3. Определим молярную массу хлоридной кислоты:
M(HCI)=1+35,5=36,5г./моль
4. Определим количество вещества хлоридной кислоты в 15,0г.:
n₁(HCI)=m(HCI)÷M(HCI)=15.0г.÷36,5г./моль=0,4моль
5. Запишем уравнение реакции:
Na₂SO₃+2HCI=2NaCI+SO₂+H₂O
а) по уравнению реакции количество вещества:
n(Na₂SO₃)=1моль n(HCI)=2моль
б) по условию задачи количество вещества:
n₁(Na₂SO₃)=0,16моль n₁(HCI)=0,4моль - хлоридна кислота дана в избытке. Дальше задачу решаем, используя количество вещества сульфита натрия:
в) по уравнению реакции количество вещества:
n(Na₂SO₃)=1моль n₁(SO₂)=1моль
г) по условию задачи количество вещества:
n(Na₂SO₃)=0,16моль n₁(SO₂)=0,16моль
6. Определим объем оксида серы(IV) количеством вещества 0,16моль :
V(SO₂)= n₁(SO₂)×Vm=0,16моль×22,4л./моль=3,58л.
7. ответ: объем выделившегося газа оксида серы(IV) 3,58л.
а) Ва + O2→ BaO2
б) SO2 + H2O→ H2SO3
в) Nа2O + H2O→2NaOH