Пример:
Вычислите долю выхода продукта реакции ŋ, если при окислении 13,8 г этанола избытком оксида меди(II) получен альдегид, масса которого составила 9,24 г.
Дано:
m(С2Н5ОН) = 13,8 г
mпракт.( СН3СОН) = 9,24 г
Найти: ŋ - ?
Решение:
1) Составим уравнение реакции
С2Н5ОН + CuО => СН3СОН + Cu + Н2О
2) Вычислим молярные массы
М(С2Н5ОН) = 12*2 + 1*5 + 16 + 1 = 46 г/моль
М(СН3СОН) = 12 + 1*3 + 12 + 16 + 1 = 44 г/моль
3) Рассчитаем теоретический выход продукта реакции mтеорет. , составим пропорцию: 13,8/46 = х/44, отсюда х = 13,8*44/46 = 13,2 г
4) Вычислим долю выхода продукта реакции по формуле
ŋ = mпракт./ mтеорет *100%
5) ŋ = 9,24 г /13,2 г*100% = 70%
ответ: ŋ = 70%
Задача №1
Вычислите долю выхода продукта реакции, если при взаимодействии этана объемом 4,48 л с азотной кислотой получен нитроэтан массой 10,5 г
Задача №2
Вычислите долю выхода продукта реакции, если из 200 г глюкозы, содержащей 7% примесей, получили 75 г спирта.
Задача №3
Массовая доля крахмала в картофеле составляет 20%. Какую массу глюкозы можно получить из 1620 кг картофеля, если доля выхода продукта реакции составляет решите 3 задачи, так как показанно в примере
Вихідна суміш: V(C₃H₈) = 60 мл; V(CO) = 20 мл
Утворена суміш: V(CO₂) = 200 мл; V(O₂) = 40 мл
Объяснение:
Напишемо обидві реакції горіння
C₃H₈ + 5O₂ = 3CO₂ + 4H₂O — реакція №1
2CO + O₂ = 2CO₂ — реакція №2
Нехай об'єм чадного газу дорівнює х мл, тоді об'єм пропану буде дорівнювати 80 - х мл. В результаті реакцій відбулося зменшення об'єму на 350 + 80 - 240 = 190 мл. За законом Гей-Люссака співвідношення коефіцієнтів біля газоподібних речовин у рівнянні реакції дорівнює співвідношенню їх об'ємів. Отже можемо записати наступні схеми
Звідки зміна об'єму у першій реакції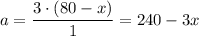
Звідки зміна об'єму у другій реакції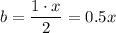
Сума змін об'ємів у двох реакціях і буде дорівнювати 190 мл. Можемо скласти рівняння
Отже, об'єм чадного газу 20 мл, а пропану 60 мл. Виконавши нескладні математичні обрахунки взнаємо, що надлишок кисню був 40 мл, і він буде присутній в утвореній суміші
Вихідну суміш ми вже описали. Опишемо утворену. За законом об'ємних відношень газів у першій реакції вуглекислого газу втричі більше ніж пропану, тобто 60 * 3 = 180 мл. У другій же реакції його стільки ж як і чадного газу, тобто 20 мл. Значить всього 180 + 20 = 200 мл
Отже утворена суміш складається з 200 мл вуглекислого газу та 40 мл кисню, що залишився