 такая реакция невозможна, поскольку условием при прохождении реакции обмена должен образоватья газ или слабый электролит или осадок. В данной реакции мы этого не видим.
такая реакция невозможна, поскольку условием при прохождении реакции обмена должен образоватья газ или слабый электролит или осадок. В данной реакции мы этого не видим.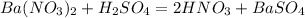 (условие неправильно записано: не
(условие неправильно записано: не 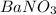 , а
, а 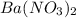 )
) (протекает при 600-700°C, реакция идет с
(протекает при 600-700°C, реакция идет с 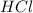 в газовом состоянии, а не с жидким
в газовом состоянии, а не с жидким 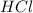 ), либо:
), либо:![2Cu+4HCl=2H[CuCl_2]+H_2](/tpl/images/0458/5320/5b6fa.png) (с концентрированной горячей соляной кислотой, с разбавленной не реагирует)
(с концентрированной горячей соляной кислотой, с разбавленной не реагирует)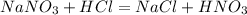 Такая реакция невозможна, как и в случае с первой реакцией. Соль образована сильной кислотой, а реакции между солями и кислотами идут только в том случае, если соль образована более слабой или летучей кислотой, или если образуется осадок.
Такая реакция невозможна, как и в случае с первой реакцией. Соль образована сильной кислотой, а реакции между солями и кислотами идут только в том случае, если соль образована более слабой или летучей кислотой, или если образуется осадок.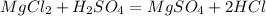 такая реакция не пойдёт, пойдёт вот такая:
такая реакция не пойдёт, пойдёт вот такая: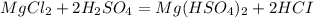 (с концентрированной
(с концентрированной 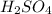 )
)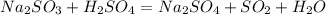 , либо
, либо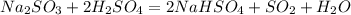 (
(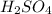 - концентрированная, холодная)
- концентрированная, холодная)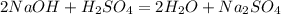
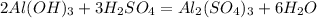
У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини. Щоб якось уявити цю закономірність, у тривимірному просторі подумки об'єднай центри молекул прямими лініями, які перетинаються. При цьому утвориться просторовий каркас, який називають кристалічними ґратками. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток. Залежно від природи частинок, що містяться у вузлах кристалічних ґраток, розрізняють йонні, атомні, молекулярні кристалічні ґратки. Відомі ще й. металічні кристалічні ґратки, їх вивчатимеш пізніше .
Йонні кристалічні ґратки. Типовим представником сполук з йонним типом кристалічних ґраток є натрій хлорид NaCl. Його кристалічні ґратки утворені йонами Натрію Na+ та йонами Хлору Сl-, які почергово розміщуються у вузлах ґраток . Иони утримуються один з одним силами притягання, і кристал солі є ніби єдиним цілим.
Оскільки в кристалі сили притягання поширюються однаково в усіх напрямках, йони Натрію і Хлору сполучаються дуже міцно, хоча кожний із них не зафіксований нерухомо. Иони безперервно здійснюють теплові коливання навколо свого положення в ґратках. Міцність йонних кристалів залежить також і від заряду та радіуса йонів. Однак їх поступальний рух уздовж ґраток не відбувається, тому всі речовини з йонним зв'язком за стандартної температури — тверді (кристалічні), з досить високою температурою плавлення і ще вищою — кипіння.
Молекул у йонних кристалах немає, є тільки йони. Лише у газуватому стані (пара) натрій хлорид існує у вигляді молекул NaCl.
Подібно до натрій хлориду майже всі солі, основні оксиди, гідроксиди складаються не з молекул, а з йонів.
Зверни увагу, хімічні формули йонних сполук передають лише співвідношення позитивно і негативно заряджених йонів у кристалічних ґратках. Йонні сполуки в цілому електронейтральні. Наприклад, згідно з формулою йонного кристала CaF2 співвідношення позитивно заряджених йонів Са2+ і негативно заряджених йонів F- у ґратках дорівнює 1:2. Оскільки кожні два позитивні заряди Са2+ нейтралізуються двома негативними зарядами 2F-, то речовина CaF2 — електронейтральна.
Хоча реальних молекул у йонних кристалах не існує, для однаковості з ковалентними речовинами прийнято за до формул NaCl, CaF2тощо передавати найпростіший склад йонної речовини та характеризувати її також певним значенням відносної молекулярної (формульної) маси на підставі її формульного складу. А поняття про валентність як певне число ковалентних зв'язків до йонних сполук застосувати неможливо (тому й будемо говорити про ступінь окиснення елементів).
Атомні кристалічні ґратки. У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Такі кристалічні ґратки має алмаз . У його кристалі кожний атом Карбону сполучений ковалентними зв'язками з чотирма сусідніми атомами Карбону, тобто утворює чотири спільні електронні пари. Ось чому можна говорити, що Карбон — чотиривалентний елемент.
-4 +1 +4 -2
Ступінь окиснення Карбону також -4 або +4, залежно від того, з яким елементом він взаємодіє — СН4, СО2.
Алмаз та інші речовини, які мають атомні кристалічні ґратки, характеризуються великою твердістю, дуже високими температурами плавлення і кипіння, вони практично не розчиняються в жодних розчинниках, не проводять електричний струм, оскільки вільних електронів немає, всі 4 валентні електрони беруть участь в утворенні ковалентних зв'язків. Атомні ґратки мають лише деякі речовини у твердому стані (силіцій Si, бор В, силіцій(IV) оксид SiO2, силіцій(ІV) карбід SiC та ін.).
Молекулярні кристалічні ґратки. У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Наприклад, у вузлах кристалічних ґраток йоду містяться молекули йоду І2 (мал. 19). Сили міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса, значно слабкіші за сили ковалентного зв'язку. Тому речовини з молекулярними ґратками мають невелику твердість, вони легкоплавкі і леткі. До таких речовин належать, наприклад, йод, нафтален, бром, вода, спирт, хлор, амоніак NH3, метан СН4.
Отже, будова речовини та її властивості пов'язані. Тому якщо відома будова речовини, можна прогнозувати її властивості, і навпаки, якщо відомі властивості речовини, можна робити висновки про її будову.