 моль ⇒ n(C)=0,3 моль
моль ⇒ n(C)=0,3 моль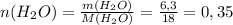 моль ⇒ n(H)=0,7 моль
моль ⇒ n(H)=0,7 моль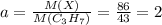
Первой реакцией является реакция с хлоро-содержащим окислителем (реакция с HCl не подходит из-за слабой окислительной вместо Железа (3) получим Железо (2))
1) 2Fe+3Cl2=2FeCl3;
Поскольку гидроксид железа (3) - нерастворимое вещество, можно его получить реакцией со щелочью:
2) FeCl3+3NaOH=Fe(OH)3+3NaCL;
Разложение термически неустойчивого гидроксида приводит к оксиду железа (3):
3)2Fe(OH)3=Fe2O3+3H2O (разложение при температуре);
Восстановление оксида железа (3) водородом при повышенной температура даст желаемый продукт:
4) Fe2O3+3H2=2Fe+3H2O.
Si + 4HNO₃ → SiO₂ + 4NO₂ + 2H₂O
Si в данном случае имеет нулевую с.о.
SiO₂ = 2*2 = +4 у кремния.
-
HNO₃ = 3*2-1 = +5 у азота.
NO₂ = 2*2 = +4 у азота.
-
Составим электронный баланс между ними:
Si⁰ - 4e⁻ → Si⁺⁴ | 1 восстановитель окисление
N⁺⁵ + 1e⁻ → N⁺⁴ | 4 окислитель восстановление
-