ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
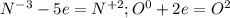 (1-(окисление азота) и (восстановление кислорода)
(1-(окисление азота) и (восстановление кислорода)
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем 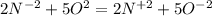 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
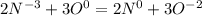 ,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
Объяснение:
1. Они диссоциируют одинаково: на катион водорода и анион кислотного остатка, следовательно, меняют цвет индикаторов. Подобно неорганическим кислотам, карбоновые кислоты являются слабыми электролитами, а потому диссоциируют обратимо:
СН3 СООН →СН3СОО- + Н+
взаимодействует с металлами, стоящими в ряду напряжения металлов до водорода:
2СН3 СООН + Мg → (СН3 СОО)2Мg + Н2
как и неорганические, взаимодействует с основными и амфотерными оксидами с образованием соли и воды:
2СН3 СООН + МgО = (СН3 СОО)2Мg + Н2О,
2СН3 СООН + ZnО = (СН3 СОО)2 Zn + Н2О.
Вступают в реакцию нейтрализации с основаниями и амфотерными гидроксидами:
2СН3 СООН + Сu(ОН) 2 = (СН3 СОО)2Сu + 2Н2О,
2СН3 СООН + Zn(ОН) 2 = (СН3 СОО)2 Zn + 2Н2О
как слабый электролит взаимодействует с солями более слабых кислот, что характерно и для неорганических кислот:
2СН3 СООН + СaСО3 = (СН3 СОО)2 Са + Н2О + СО2
Если взять реакцию эстерификации (СН3 СООН + С2Н5ОН → СН3 СООС2Н5 + Н2О) то и неорганические кислоты могут вступать в реакции со спиртами, например, реакция нитрования многоатомного предельного спирта глицерина. При этом так же образуется сложный эфир.
2. 1)Молекулы всех органических кислот содержат атомы углерода, а практически все и атом водорода. У неорганических (кроме угольной) атомы других элементов в кислотном остатке. 2) Катион находится в конце формулы.
3. Наличием иона водорода.
Все свойства карбоновых кислот связаны с присутствием в их молекуле гидроксильной группы.
4. для предельных одноосновных карбоновых кислот характерны такие же свойства, что и для неорганических кислот. В этом заключается их сходство. Предельные одноосновные карбоновые кислоты диссоциируют, взаимодействуют с металлами, стоящими в ряду напряжения металлов до водорода, основными и амфотерными оксидами, основаниями, амфотерными гидроксидами и солями
2HNO3 + AgNO2 = AgNO3 + 2NO2 + H2O
Method of electronic balance
N5+ + 1e = N4+
Ag0 - 1e = Ag1+
Объяснение:
2 не знаю