Дано:
m (C6H5OH) = 4,7 г
m р-р (KOH) = 120 г
w р-р (KOH) = 14%
Найти:
m(C6H5OK)
найдем массу гидроксида калия:
m(KOH) = mр-ра ∙ w(р-ра) 100% = 120 г ∙ 14%\100% = 16,8 г
4,7 г 16,8 г х г
C6H5OH + KOH = C6H5OK + H2O
94 г 56 г 132 г
n = m \М
n (C6H5OH) = 4,7 \94 = 0,05 моль (недостаток)
n (KOH) = 16,8 \56 = 0,3 моль (избыток)
вычислим массу образовавшегося C6H5OK: (расчет по недостатку)
4,7 г х г
94 г --- 132 г
х = 4,7 г ∙ 132 г\94 г = 6,6 г
ответ: m(С6H5OK) = 6,6 г
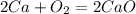
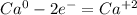 ·2 восстановитель полуреакция окисления
·2 восстановитель полуреакция окисления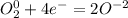 ·1 окислитель полуреакция восстановления
·1 окислитель полуреакция восстановления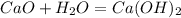
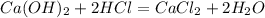
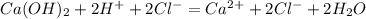
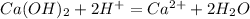
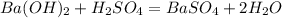
![m[Ba(OH)_2]=](/tpl/images/0276/7725/752a4.png) =50 · 0,18 = 9 г
=50 · 0,18 = 9 г![n[Ba(OH)_2]= \frac{m[Ba(OH)_2]}{M[Ba(OH)_2]} = \frac{9}{171} =0,0526](/tpl/images/0276/7725/43f28.png) моль
моль![n(BaSO_4)=n[Ba(OH)_2]=0,0526](/tpl/images/0276/7725/a4a1c.png) моль
моль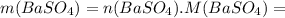 =0,0526 · 233=12,2558 г ≈12,26 г
=0,0526 · 233=12,2558 г ≈12,26 г
Объяснение:
100 мл раствор содержит 16,7 гр. КМnО4. Сколько воды и указанного раствора нужно взять для того чтобы получить 2 литр 0,5 Н раствора.
Молярная масса перманганата калия равна 158 г/моль.
В задании не указана молярная масса эквивалента KMnO4
Дело в том что
а) при титровании раствором KMnO4 в кислотной среде Эк KMnO4 равен 158 г/моль : 5 = 31,6 г/моль;
б) при титровании раствором перманганата калия в нейтральной среде Эк KMnO4 равен 158 г/моль : 3 = 52,7 г/моль;
в) при титровании раствором перманганата калия в щелочной среде Эк KMnO4 равен 158 г/моль
Найдем объем раствора перманганата в каждом конкретном случае:
а) m(KMnO4 = Cн × Экв × V (л) = 0,5 × 31,6 × 2 = 31,6 г
31,6 г : 16,7 = 1,892
100 х 1,892 = 189,2 г исходного раствора поместить в мерную колбу на 2 л, довести водой до метки и перемешать
б) а) m(KMnO4 = Cн × Экв × V (л) = 0,5 × 52,7 × 2 = 52,7 г
52, г : 16,7 = 3,155
100 х 3,155 = 315,5 г исходного раствора поместить в мерную колбу на 2 л, довести водой до метки и перемешать
в) m(KMnO4 = Cн × Экв × V (л) = 0,5 × 158 г/моль × 2 = 158 г
158 г : 16,7 = 9,46
100 х 9,46 = 946 г исходного раствора поместить в мерную колбу на 2 л, довести водой до метки и перемешать